
科目: 来源: 题型:
【题目】读图、读表是高中学生需要具备的重要能力。下列关于各图象的解读正确的是( )

A. 由甲推知氢气的燃烧热为219.8kJmol-1
B. 由乙推知离子反应Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)可以发生
C. 由丙可知:将A、B饱和溶液分别由T1℃升温T2℃时,溶质的质量分数:B>A
D. 由丁可知:同温度、同浓度NaA溶液与NaB溶液相比,其pH:NaA>NaB
查看答案和解析>>
科目: 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.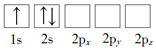 B.
B.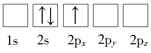
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
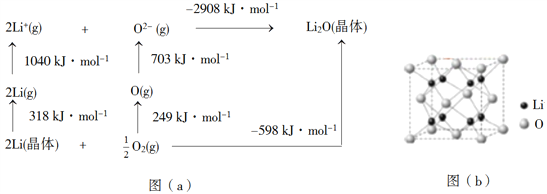
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】1998年诺贝尔化学奖授予科恩和波普尔,以表彰他们在理论化学领域作出的重大贡献.他们的实验和理论能共同协力探讨分子体系的性质.下列说法正确的是
A.未来化学的研究方向是经验化B.化学不需要再做实验
C.化学不再是纯实验学科D.化学不做实验,就什么都不知道
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )

A. 该实验说明氨气极易溶于水
B. 进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C. 氨水很稳定,将烧瓶内的红色溶液加热颜色不会发生变化
D. 形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
查看答案和解析>>
科目: 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下的可逆反应CO(g)+2H2(g)![]() CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是 ( )
CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是 ( )

A. 温度:T1 < T2 3
B. 正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C. 平衡常数: K(a) =K(c) ; K(b) >K(d)
D. 平均摩尔质量:M(a)<m(c); m(b)>M(d)</m(c); m(b)>
查看答案和解析>>
科目: 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )

A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质:①固体烧碱 ②HCl气体 ③SO3 ④CCl4⑤石墨 ⑥浓硫酸 ⑦液态醋酸 ⑧碳酸钙 ⑨熔融KCl中,(填编号,下同)
属于强电解质的是____________________,属于非电解质的是__________________,能导电的是___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】"垃圾是放错了位置的资源",应该分类回收利用.生活中废弃的铁锅,铝制易拉罐,铜导线等可以归为一类加以回收,它们属于( )
A. 有机物 B. 氧化物 C. 盐 D. 金属或合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com