
科目: 来源: 题型:
【题目】实验室用下图所示装置模拟石灰石燃煤烟气脱硫实验:

(1)实验中为提高石灰石浆液脱硫效率采取的措施是____,写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式____。
(2)将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的方法是____。
(3)研究发现石灰石浆液的脱硫效率受pH和温度的影响。烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是____,烟气通入石灰石浆液时的温度不宜过高,是因为____。

(4)石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3,实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,____。[浆液中CaSO3能充分与硫酸反应。实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]
查看答案和解析>>
科目: 来源: 题型:
【题目】超细铜粉有重要用途,工业上可以通过铝黄铜合金(含Cu、Al、Zn)制超细铜粉。某小组在实验室模拟制备超细铜粉的方法如下:
步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。
(1)步骤Ⅰ中完全溶解铝黄铜合金可以加入稀硫酸和____。
A.FeCl3 B.盐酸 C.热空气
(2)配制500 mL 1.000 mol·L-1的稀硫酸,需要用98%的浓硫酸(密度为1.84 g·mL-1)____mL。
(3)在步骤Ⅲ中生成NH4CuSO3的化学反应方程式为____。
(4)准确称取1.000 g铝黄铜合金与足量的1.000 mol·L-1稀硫酸完全反应,生成标准状况下气体体积为134.4 mL。将相同质量的合金完全溶于热的足量的浓硫酸,产生标准状况下气体体积为380.8mL。计算此合金中铜的质量分数________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
科目: 来源: 题型:
【题目】I.二甲醚(DME)-种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al203):2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:

则△H2=____。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的____(填正、负)极,通DME的电极反应为
Ⅱ.2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ/mol(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为

①________________________

(2)T=673K,合成氨反应的热化学方程式为______________
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4C1类似。写出盐酸肼第一步水解反应的离子方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发、结晶、________。
(2)除去KCl溶液中的SO![]() ,依次加入的溶液为(填溶质的化学式): ________________________。
,依次加入的溶液为(填溶质的化学式): ________________________。
(3)下列物质的分离和提纯方法操作为
①油水混合物________;
②自来水制备蒸馏水________;
③碘水中的I2________;
④KNO3溶液得到KNO3________。
查看答案和解析>>
科目: 来源: 题型:
【题目】抗菌药奥沙拉秦钠可通过下列路线合成:

(1)化合物B中的含氧官能团为____、____(写官能团名称)。
(2)由D→E的反应类型为____。
(3)写出C的结构简式____。
(4)写出C同时满足下列条件的一种同分异构体的结构简式____。
Ⅰ.能发生银镜反应; Ⅱ.能与FeCl3溶液发生显色反应;
Ⅲ.分子中有4中化学环境不同的氢
(5)已知![]() 易被氧化。请写出以甲醇、苯酚和
易被氧化。请写出以甲醇、苯酚和![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题干)____。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题干)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】活性ZnO在橡胶、塑料等工业中有重要应用,某工厂以含铅锌烟气(主要成分是ZnO、PbO,还有少量FeO、CuO)制备活性ZnO的工艺流程如下:

(1)下图为温度与Zn、Pb元素浸出率的关系图,“酸浸”时采用30℃而不是更高的温度的原因是:①减少盐酸挥发;②____。

(2)“氧化”的目的是除去酸浸液中的Fe2+,在pH约为5.1的溶液中,加入高锰酸钾溶液,生成MnO2和Fe(OH)3沉淀,该反应的离子方程式为____。
(3)①若“过滤I”所得的滤液浑浊,则处理的方法为____。
②“除杂”时,滤渣Ⅱ的主要成分是Cu、Pb,试剂X应为____。
(4)在“过滤Ⅱ”后的溶液中加入Na2CO3溶液,生成碱式碳酸锌[Zn2(OH)2CO3]等物质。
①该反应的化学方程式为____。
②检验碱式碳酸锌洗涤干净的操作为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。右图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。右图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
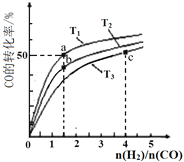
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡向正方向移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中CH3OH的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)烷烃A在同温、同压下蒸气的密度是H:的43倍,其分子式为____分子中含102个氢原子的烷烃的分子式是_____
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__种。
(3)有机物 的正确命名为___________
的正确命名为___________
(4)立方烷 它的六氯代物有____种。
它的六氯代物有____种。
(5)  分子中最多有个____原子共面.
分子中最多有个____原子共面.
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.10 mol·L-1的NaOH溶液,整个过程中溶液pH变化的曲线如图所示。下列叙述中正确的是

A. 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. 点②所示溶液中:c(H+)>c(Cl-)>c(ClO—)>c(HClO)
C. 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com