
科目: 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过________mol电子。

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极会产生气泡,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因________________________________________________________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO![]() ,试写出该反应(红色褪去)的离子方程式:__________________________________________。
,试写出该反应(红色褪去)的离子方程式:__________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝电极反应为___________;乙装置中石墨(1)电极现象为__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法正确的是( )
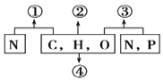
A. 若①为某种大分子的组成单位,则①可能是肽链
B. 若④是主要在动物肝脏和肌肉中合成的储能物质,则④一定是糖原
C. 若③为能储存遗传信息的大分子物质,则③一定是DNA
D. 若②是细胞中重要的储能物质,则②一定是脂肪
查看答案和解析>>
科目: 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A. 电池工作时OH-向负极迁移
B. 正极反应式为2Fe![]() +
+![]() =Fe2O3+5H2O
=Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度不变
D. 电子由Zn电极流出,经KOH溶液流向正极
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题目要求,用化学语言回答问题。
(I)除去下列括号内的杂质通常采用的实验方法是什么?将答案填在横线上。
(1)CH3CH2OH(H2O)_____________________________________________________;
(2)![]() (NaCl)____________________________________________;
(NaCl)____________________________________________;
(3) ![]() (Br2)___________________________________________________。
(Br2)___________________________________________________。
(II)某有机物的实验式为C2H6O,用质谱仪测定其相对分子质量,经测定得到如图1所示的质谱图;最后用核磁共振仪处理该有机物,得到如图2所示的核磁共振氢谱图。

试回答下列问题:
(1)该有机化合物的相对分子质量为________。
(2)请写出该有机化合物的结构简式________。
(III)有机物E(C3H3Cl3)是一种播前除草剂的前体,其合成路线如下。

已知D在反应⑤中所生成的E,其结构只有一种可能,E分子中有3种不同类型的氯(不考虑空间异构)。试回答下列问题:
(1)利用题干中的信息推测烃A的结构简式为______________。烃A的同系物中,相对分子质量最小的烃发生加聚反应的化学方程式为____________________________。
(2)写出下列反应的类型:反应①是____________,反应③是________。
(3)利用题干中的信息推测有机物D的名称是______________。
(4)试写出反应③的化学方程式:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=6.0×10-4,Ksp(MgF2)=5.0×10-11。现向1 L 0.2 mol·L-1 HF溶液中加入 1 L 0.2 mol·L-1 MgCl2溶液。下列说法中正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. 0.2 mol·L-1 MgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-)
C. 2HF(aq)+Mg2+(aq)![]() MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
D. 该反应体系中有MgF2沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25 ℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1 L混合溶液,根据上表数据判断,下列说法不正确的是( )
A. 在pH=5的溶液中,Fe3+不能大量存在
B. 混合溶液中c(SO![]() )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
C. 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀
D. 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH)=c(K+)>c(Ba2+)
B. 将10 mL 0.1 mol·L-1Na2CO3溶液逐滴滴加到10 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO)>c(CO![]() )
)
C. 向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH)+c(Na+)=c(HCO)+c(CO![]() )
)
D. 0.2 mol·L-1的某一元弱酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com