
科目: 来源: 题型:
【题目】石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。

(1)图甲中,1号C与相邻C形成σ键的个数为__________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角__________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为____________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

①“可燃冰”中分子间存在的2种作用力是___________________________;
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想的依据是:______________________________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是( )

A. 图1中,插入海水中的铁棒,越靠近底端,腐蚀越严重
B. 镀层破损后,镀锌铁比镀锡铁更耐用
C. 纯银器表面在空气中因电化学腐蚀渐渐变暗
D. 图2中,金属棒X若为Cu,可使埋在地下的钢管免受腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】铝–空气燃料电池具有原料易得、能量密度高等优点,装置如图所示,电池的电解质溶液为KOH溶液。下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电过程的负极反应式:Al+4OH--3e–=[Al(OH)4]-
D. 放电时,有4mol OH-通过阴离子交换膜,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)2NO2(g)的反应历程分两步:
I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为: Fe2e===Fe2+
C. a和b用导线连接时,电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,任写一种该物质的用途:_______________。
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)若Ksp(ZnCO3)=1.5×10﹣10,溶液中离子浓度≤1.0×10﹣5molL﹣1时,认为该离子沉淀完全。则欲使1Lc(Zn2+)=1.5molL﹣1溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为_______________________molL﹣1 (写出精确计算结果,溶液混合时体积变化忽略不计)。
(5)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有______;洗涤沉淀的操作为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )

A. 氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B. 电解精炼铜时,Y是粗铜
C. 在铁片上镀铜时,X是纯铜
D. 制取金属铝时,Z是氯化铝溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。
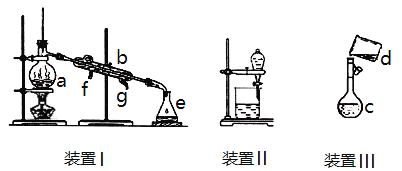
(1)写出下列仪器的名称:a.___________________b.____________________。
(2)若利用装置I分离四氯化碳和酒精的混合物,冷凝水由_____(填f或g)口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_____________。
(4)实验室用Na2CO3·10H2O晶体配制0.05mol/L的Na2CO3溶液970mL。
①应用托盘天平称取Na2CO3·10H2O的质量是_____________g。
②装置III是某同学转移溶液的示意图。图中的错误是___________________。
(5)定容时,俯视刻度线,对所配溶液浓度的影响:_____________(填:偏大、偏小、或无影响)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
②2SO2+SeO2+2H2O===Se+2SO42—+4H+。
(1) Se与浓H2SO4的反应中,氧化剂是________________,还原剂是_______________。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________。
(3)用单线桥法标出反应②电子转移的方向和数目:_____________________________。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3―→Se+I2+KNO3+H2O配平上述反应的化学方程式______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )

A. 该反应的ΔH=+91 kJ·mol-1
B. 加入催化剂,该反应的ΔH变小
C. 反应物的总能量小于生成物的总能量
D. 如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com