
科目: 来源: 题型:
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
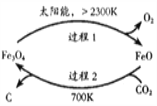
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:
①捕获1molCO2转移电子的物质的量是_________。
②过程2反应的化学方程式是__________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
按投料比n(CO2) : n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
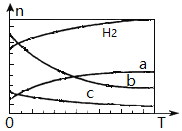
①正反应的焓变△H_______0 。
②提高CO2的转化率,可采用的方法是_______。
A.减小n(CO2)与n(H2)的投料比
B.改变催化剂
C.缩小容器体积
③图中表示乙烯的曲线是_______。
(3)以NH3与CO2为原料,合成尿素[化学式:CO(NH2)2]:
反应如下:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol
③H2O(l)=H2O(g) △H=+44.0kJ/mol
CO2与NH3形成液态水时,合成尿素的热化学方程式是_______________;
(2)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极,将CO2转化为丙烯的原理模型。
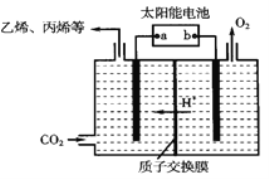
①太阳能电池的负极是_________。
②生成丙烯的电极反应式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤造成的S2的大量排放已经给我们的生存环境造成了严重破坏,科学研究发现:一定条件下,通过下列反应可实现燃煤烟气中硫的回收。
(1)已知:2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
则反应2CO(g)+SO2(g) ![]() 2CO2(g)十S(l) △H=________ kJ/mol
2CO2(g)十S(l) △H=________ kJ/mol
(2)燃煤烟气中硫的回收反应的平衡常数表达式K=_________。在温度和容积不变时,下列说法正确的是_________ (填字母序号)
A.容器内压强不再改变时,反应达到平衡状态
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.当n((CO):n(SO2):n(CO2)=2:1:2时,反应达到平衡状态
D.其他条件不变,使用不同催化剂,该反应平衡常数变化
(3)假设在容器中发生上述反应,下列能提高SO2转化率的是_________(填字母序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.增大容器的体积
(4)SO2尾气处理的方法之一是将尾气直接通入NaOH溶液中。若将 1mol SO2气体通入1L2mo1/L的NaOH溶液中所得溶液中离子浓度由大到小的顺序为_____________;
(5)尾气中的CO可以制成CO-----空气燃料电池。CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。该电池负极的电极反应式为_______________;总反应式为__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.4.1gH3PO3可与2gNaOH完全反应生成正盐,则H3PO3为__________元酸。该正盐的电离方程式为_________________。
Ⅱ、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504gNaHCO3,2片小苏打片能中和胃酸中的H+是_____mol。
(2)胃舒平每片含0.234gAl(OH)3,中和胃酸时,6片小苏打片相当于胃舒平__________。
(3)达喜的化学成分是铝和镁的碱式碳酸盐。取该碱式盐粉末3.01g,逐滴加入2.0mol/L盐酸使其溶解(其他成分不与盐酸反应),当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时怡好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是

A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质:①氢氧化钠溶液、②铜片、③碳酸钙、④蔗糖、⑤熔融的NaCl、⑥SO2气体、⑦碳酸氢钠、⑧盐酸
(1)能导电且属于电解质的是___________。(填编号)
(2)写出碳酸钙的电离方程式____________________________________。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式____________________________________。
(4)向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
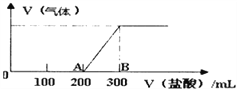
则
①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为_________(写化学式)。
②盐酸的浓度为________________________。
③B点时,产生的气体在标准状况下的体积为_________________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①②③三种不同的环境中

请回答:
(1)金属腐蚀主要分为__________腐蚀和_____________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是_________________(填序号)。
(3)①中正极的电极反应式为_________________________________________________,②中负极的电极反应式为_________________________________________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有__________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
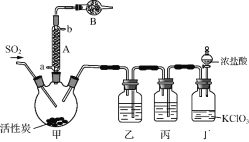
(1) 仪器A冷却水的进口_______(填“a”或“b”)。
(2) 仪器B中盛放的药品是_______。
(3) 实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为_______,以下与二氧化硫有关的说法中正确的是_______。
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4) 装置丙所盛试剂为_______,若缺少装置乙,则硫酰氯会损失,该反应的化学方程为______________。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是______________。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
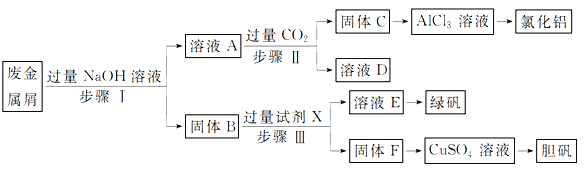
请回答:
(1)写出步骤Ⅰ反应的离子方程式:____________________________。
(2)试剂X是______________。溶液D是______________。
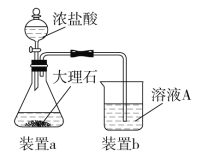
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_____________________。
(4)由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀浓硫酸中,然后通入氧气;
方法一的缺点为:_________________________________________________。
(5)工业上常用溶液E制得净水剂Na2FeO4,流程如下:

①测得溶液E中c(Fe2+)为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25%的H2O2溶液_______kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式______________。(已知NaClO还原为NaCl)
查看答案和解析>>
科目: 来源: 题型:
【题目】在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )

A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com