
科目: 来源: 题型:
【题目】现有浓度均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合。已知Mg(OH)2的Ksp=4.0×10—12,下列说法正确的是
A、混合前,氨水溶液中c(NH4+):c(OH—)=1:1
B、混合后c(NH4+):c(Cl—)=1:1
C、混合后c(Mg2+)×c(OH—)= 4.0×10—12
D、向混合后的分散系中加入FeCl3溶液,白色沉淀变红褐色
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下左图所示,根据判断出的元素回答问题:

⑴ f在元素周期表的位置是__________。
⑵ 比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________
⑶ 任选上述元素组成一种四原子共价化合物,写出其电子式____________________
⑷ 已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式____________
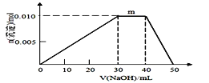
⑸ 上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如上右图所示:
① R溶液中离子浓度由大到小的顺序是________________
② 写出m点反应的而离子方程式________________________________
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法不正确的是( )
A. 除去乙酸乙酯中混有的乙酸,可以用饱和碳酸钠溶液
B. 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同
C. 聚合物![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
D. C3H2Cl6有4种同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是
A. Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化
B. Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化
C. MgCO3电离出的CO![]() 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. 二者不能相互转化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有1mL 0.01 mol/L | 证明在相同温度下的 Ksp(AgCl)>Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。
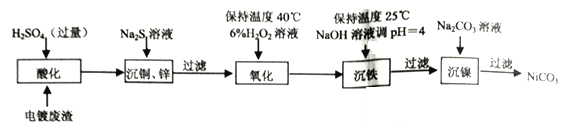
(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
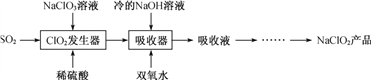
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
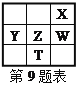
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示。常温下,B、E呈气态,其中B呈黄绿色。D是最常见的无色液体,E常用作制冷剂,F是一种不溶于水的碱,G是厨房中的常见调味品,H由两种元素组成,其摩尔质量为32 g·mol-1。

(1) E的电子式为____。
(2) H的化学式为____。
(3) 写出反应①的离子方程式:_________________。
(4) 写出反应②的化学方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com