
科目: 来源: 题型:
【题目】请根据要求填空:
(1)水的电离与溶液的酸碱性密切相关。
①常温下,某柠檬水溶液的pH=3,其中的c(OH-)=__________。
②常温下,浓度均为0.1 molL-1的CH3COOH溶液和CH3COONa溶液中,水的电离程度大小关系是:前者_____________后者(填“>”“<”或“=”);
③常温下,浓度均为0.1 molL-1的NaX和NaY两种盐溶液,其pH分别为8 和10,则HX 和HY的酸性强弱关系是:HX_________HY(填“>”或“<”)。
(2)研究化学能与电能相互转化的装置、过程和效率的科学,叫做电化学。
①某原电池装置如右图,则:
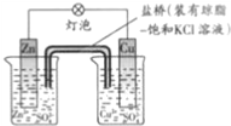
该原电池的负极是__________(填“Zn”或“Cu”),正极的电极反应式为_______________________;
②用铂电极电解某金属氯化物(XCl2)的溶液,当收集到2.24 LCl2(标准状况)时,阴极增重6.4 g,则该金属的相对原子质量为_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
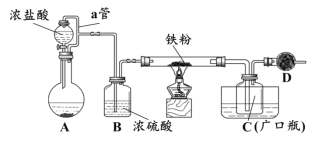
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
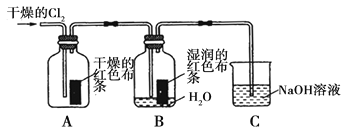
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
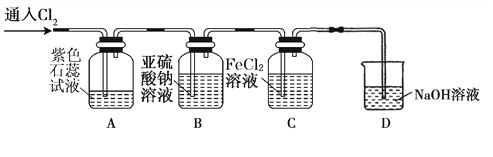
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化:
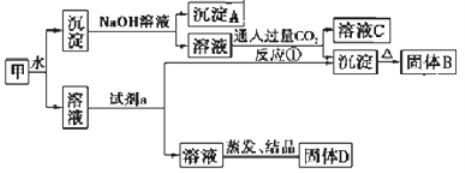
请回答下列问题:
(1)写出A、B的化学式:A__________,B__________。
(2)试剂a最好选用下列试剂中的______________。
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式_____________________________________。
(3)写出反应①(生成溶液C和沉淀)的离子方程式______________。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源。实验室常用下列装置(夹持装置已略去)制备无水NiCl2。
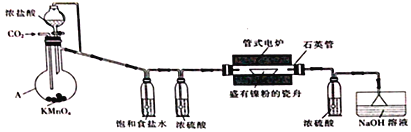
实验步骤如下:
I.按图示连接好装置,检查装置气密性后,先向装置中通入干燥的CO2。
II.约20min后,停止通入CO2,改为通儒Cl2并使装置中充满Cl2。
III.将电炉升温至750℃,在氯气流中加热约lh。
IV.在氯气流中冷却至室温后,再继续通入CO2约10min。
回答下列问题:
(1)仪器A的名称为_____________________________。
(2)步骤I中通入CO2的目的是___________________________。
(3)A中生成Cl2的离子方程式为______________________________________。
(4)判断步骤II中氧气已充满装置的现象是______________________________________。
(5)步骤IV中通入CO2的目的是______________,水槽中NaOH溶液的作用是_____________________。
(6)反应前石英管及瓷舟的总质量为m1、放入镍粉后石英管及瓷舟的总质量为m2,氧化反应后石英管及瓷舟的总质量为m3,则产品中n(Ni)/n(Cl)=________(填计算表达式)。
(7)实验室也可用NiCl2·6H2O与液态SOCl2混合加热制取无水NiCl2,其反应的化学方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
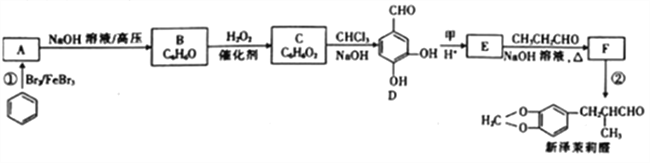
已知:①RCHO+R'CH2CHO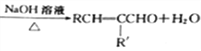
②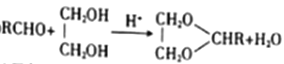
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备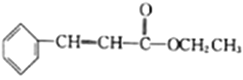 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1H2SO3溶液过程中的pH变化如图所示。下列说法错误的是
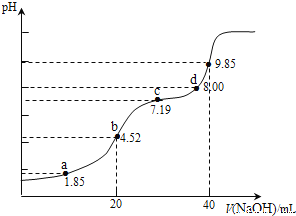
A. a点所得溶液中:3c(H2SO3)+3c(HSO3-)+3c(SO32-)=0.2000molL-1
B. b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c点所得溶液中:c(SO32-)=c(HSO3)
D. d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
科目: 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
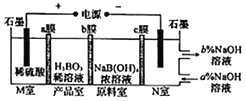
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合物![]() (W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:
(W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:

已知:①A中官能团不在同一个碳原子上。
②![]()
③R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
(1)B所含的官能团名称是__________。
(2)E的名称是__________,G生成H的反应类型是__________。
(3)写出D生成E的化学方程式是______________________。
(4)X的结构简式_______________。
(5)E存在多秧同分异构体,与E具有相同官能团且不能发生银镜反应的同分异构体有__________种(不考虑立体结构,不含E)。其中符合核磁共振氢谱中峰面积之比3:3:2 的结构简式________________________。
(6)以CH3CH2OH为原料(无机试剂任选)合成环丁烯,试写出合成流程图______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com