
科目: 来源: 题型:
【题目】十九大报告提出了“积极参与全球环境治理,落实减排承诺”。其中氮的化合物的处理和利用是环境科学研究的热点。
(1)机动车排放的尾气中主要污染物为NOx ,可用 CH4 催化还原 NOx 以消除其污染。298 K时,1.0 g CH4 (g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72. 5 kJ的热量。该反应的热化学方程式为_______________。
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=___________;K1、K2、K3的关系为K3=____________。
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
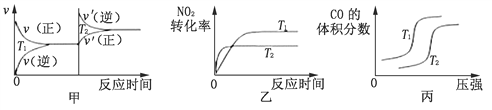
(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s) +2NO(g)![]() N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
① T1℃时,该反应在0~20min的平均反应速率v(CO2)=__________________;该反应的平衡常数K= _____________;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填序号);
A. 加入一定量的活性炭 B. 恒温恒压充入氩气
C. 适当缩小容器的体积 D. 加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率_____________(填“升高”或“降低”),ΔH_______0(填“﹥”、“﹤”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
科目: 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,已知草酸铝[Al2(C2O4)3]难溶于水。则下列有关说法正确的是
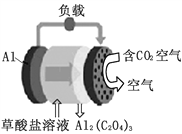
A. 该装置将电能转变为化学能
B. 正极的电极反应为C2O42--2e-===2CO2
C. 每生成1molAl2(C2O4)3,有6mol电子流过负载
D. 草酸盐溶液中的阳离子移向Al电极
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
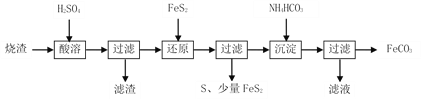
(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com