
科目: 来源: 题型:
【题目】甲、乙两位同学设计实验确定某酸HA是弱电解质,实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1 的HA溶液、稀盐酸各10 mL,按图装好,观察现象。

乙:方案一:用pH计测定浓度为 0.1 mol·L-1HA溶液的pH;
方案二:取pH=3的HA溶液5 mL稀释至500 mL,再用pH计测其pH。
回答下列问题:
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是___________ (填序号)。
A. 加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B. 加入HA溶液后,试管上方的气球鼓起慢
C. 加入稀盐酸后,试管上方的气球鼓起慢
(2)乙同学设计的方案一中说明HA是弱电解质的理由是:测得 0.1 mol·L-1 的HA溶液的pH ______1(填“>”、“<”或“=”);
(3)乙同学设计的方案二能证明改变条件,弱电解质电离平衡发生移动。乙同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在 0.1mol·L-1 的HA溶液中,选择加入____________试剂;
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在 0.1mol·L-1 的HA溶液中,选择加入_____________试剂。
(4)若从水解原理角度设计一个合理而比较容易进行的方案(药品可任取) ,证明HA是弱电解质,你的设计方案是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=_______;该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为______(用序号回答)。
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________,则a_______ b(填“﹥”、“﹤”或“=”)。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液 ④40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是_____(用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】屈昔多巴( ![]() )是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线(
)是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线( ![]() 简写为BnCl,
简写为BnCl, ![]() 简写为CbzCl ):
简写为CbzCl ):

回答下列问题:
(1)反应①的反应类型为_________,其作用为_____________。
(2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有_____个手性碳原子。
(3)反应②为加成反应,则有机物X的名称为________________。
(4)![]() 显________性(填“酸”、“中”或“碱”)。
显________性(填“酸”、“中”或“碱”)。
(5)![]() 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线: __________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________,其价层电子排布图为____________,根据_____________原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______区;根据元素周期律,电负性B_______C,第一电离能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________,它是_________分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________(填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
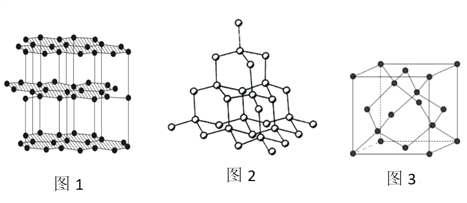
①图1所对应的同素异形体可以导电,试从其结构予以解释_________。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________。(![]() =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
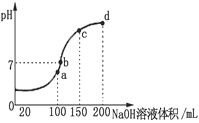
(4)浓度均为0.1 mol·L-1 NH4Al(SO4)2溶液和NH4HSO4溶液,其中______溶液c(NH4+)大。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘在自然界中有很多存在形式,在地壳中主要以NaIO3 形式存在,在海水中主要以I-形式存在,几种粒子与Cl2之间有以下转化关系:
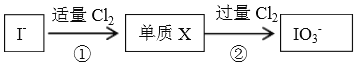
以下说法不正确的是
A. ①中发生的反应是:2I-+Cl2=I2+2Cl-
B. I-与过量Cl2发生的反应是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反应中,氯气都体现氧化性,具体表现为:氯元素由0价降低为-1价
D. 通过以上信息,可预测:若在加入淀粉的KI溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象
查看答案和解析>>
科目: 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知用含硫酸铁的废液(含少量杂质)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:

回答下列问题:
①试剂X是_______,写出发生的主要反应的离子方程式___________。
②操作Ⅱ的名称为:________、_________。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/LKMnO4溶液滴定,测得消耗KMnO4溶液的平均体积为22.00mL。
滴定终点的现象为: _______________________;该晶体中铁的质量分数为___________。(保留4位有效数字)
(2)某课题组通过实验检验摩尔盐晶体加热时的分解产物。
①摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、NH3、SO3、H2O
c.FeO、SO2、NH3、H2Od.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想___________不成立(填序号)。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有_____________;C装置中红色褪去,说明气体产物中含有__________;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是__________(写一种即可)。

③丙同学想利用上述装置证明分解产物中含有氨气。只需更换B、C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为摩尔盐分解可能会生成N2和SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】CO2、CO可与H2在一定条件下反应合成二甲醚(CH3OCH3)、甲醇(CH3OH)、草酸(H2C2O4)等化工原料。
(1)二甲醚可作为绿色环保型能源。二甲醚空气燃料电池的工作原理如图所示。该电池工作时,c通入的物质为______________ ,该电极的电极反应式为_______________。
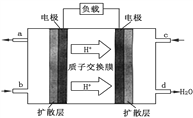
(2)某同学用甲醇和其它试剂组装了如下图所示装置,来研究有关电化学问题(甲、乙、丙三池中电解质足量)。当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
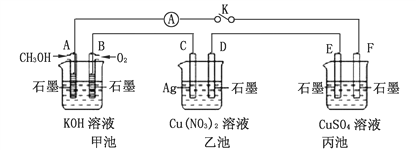
①丙池中F电极为____________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为_______________;
②若丙池溶液的体积为500 mL,当乙池中C极质量减轻5.4g时,丙池溶液的pH为_______(忽略溶液体积的变化);
③一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是______ (填序号)。
A. Cu B. CuO C. Cu(OH)2 D. Cu2(OH)2CO3
(3)已知:常温下,H2C2O4的电离常数分别是Ka1≈5.0×10-2,Ka2≈6.0×l0-5。草酸的钾盐有K2C2O4、KHC2O4。常温下,KHC2O4的水解常数Kh2=___________,KHC2O4溶液的pH______7(填“﹥”、“﹤”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
H-H | N-H | N-N | N≡N |
435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com