
科目: 来源: 题型:
【题目】为确定盐酸、碳酸、硅酸的酸性强弱,设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。(提示:检验酸的酸性强弱可用强酸制取弱酸)

(1)锥形瓶中装某可溶性正盐,分液漏斗中所盛试剂应为________。
(2)装置B中所盛试剂是________________________________________,其作用是_____________。
(3)装置C中所盛试剂是___________________________________________,
C中反应的离子方程式是_________________________________________________。
(4)由此得到的结论是酸性:________>________>________。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的固定意义重大,氮肥的大面积使用提高了粮食产量。
(1)目前人工固氮有效且有意义的方法是_______________(用一个化学方程式表示)。
(2)自然界发生的一个固氮反应是N2(B)+O2(g) ![]() 2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,则该反应的△H=____kJ·mol-1。
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,则该反应的△H=____kJ·mol-1。
(3)恒压100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
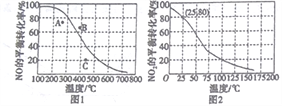
①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则____________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则____________点对应的压强最大。
②恒压100kPa、25℃时,2NO2(g) ![]() N2O4(g)平衡体系中N2O4的物质的量分数为______________,列式计算平衡常数Kp=____________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中N2O4的物质的量分数为______________,列式计算平衡常数Kp=____________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)室温下,用往射器吸入一定量NO2气体,将针头插入胶塞密封,然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间。从活塞固定时开始观察,气体颜色逐渐__________(填“变深”或“变浅”),原因是________________。[已知2NO2(g)![]() N2O4(g)在几微秒内即可达到化学平衡]
N2O4(g)在几微秒内即可达到化学平衡]
查看答案和解析>>
科目: 来源: 题型:
【题目】填写下列空白:
(1)含有6.02×1023个H的H2O,其物质的量是_______;1 mol Na2SO4溶于水能电离出______个Na+。
(2)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(4)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(5)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A. 2.1g B. 3.6g C. 7.2g D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,下图所示是从铝土矿中制备铝的工艺流程:

已知:溶液中硅酸钠与偏铝酸钠反应能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH。下列说法不正确的是
A. 滤渣A的成分为Na2Al2Si2O8和Fe2O3
B. 用过量CO2酸化,生成Al(OH)3的反应:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. 过滤操作时,用玻璃棒搅拌,可以加快过滤速度
D. 灼烧操作前,坩埚需先洗净,再擦干
查看答案和解析>>
科目: 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(aq,橙色)+H2O(l)![]() 2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
A. 上述反应平衡常数的表达式为:K=[c(H+)·c2(CrO42-)]/[c(Cr2O72-)·c(H2O)]
B. 实验①现象:溶液由橙色变为黄色,实验②现象:溶液由黄色变为橙色
C. 实验①和②的目的是探究H+浓度对上述平衡的影响
D. 预测稀释K2Cr2O7溶液时,溶液颜色由橙色变为黄色
查看答案和解析>>
科目: 来源: 题型:
【题目】在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
A. Cl2是氧化剂,KOH是还原剂
B. KCl是还原产物,KClO3是氧化产物
C. 反应中每消耗3 mol Cl2,转移电子数为5NA
D. 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍
查看答案和解析>>
科目: 来源: 题型:
【题目】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是

A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com