
科目: 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是
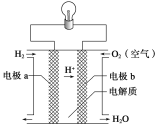
A. 该电池中电极a是正极
B. 外电路中电子由电极b通过导线流向电极a
C. 该电池的正极反应为O2+4H++4e- = 2H2O
D. 该电池的总反应:2H2+O2 = 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为合成氨反应(N2+ 3H2![]() 2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是
2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是

A. 温度(T/K) B. 压强(P/Pa)
C. 反应时间(t/min) D. 氮气浓度(c/mol·L―1)
查看答案和解析>>
科目: 来源: 题型:
【题目】一种锂铜可充电电池,工作原理如下图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(Li+交换膜)隔开。下列说法不正确的是

A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N极为电池的正极
C. 充电时,阳极反应为:Cu-2e-== Cu2+
D. 充电时,接线柱A应与外接电源的正极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W__________、X__________、Y__________、Z__________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是____________(写化学式),还原剂是____________(写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________。
②化学方程式:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
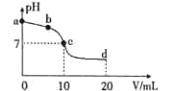
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 4.6 g NO2和N2O4混合物中含氧原子数为0.3 NA
C. 标准状况下,6.72 L NO2与水反应,转移电子数为0.3 NA
D. 0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
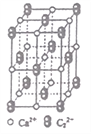
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为_________。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________________;分子中处于同一直线上的原子数目最多为_______________。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),则该晶胞中的碳原子个数为______。 CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2 晶体中1个Ca2+周围距离最近的C22-数目为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
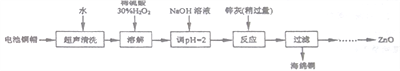
(1)①铜帽溶解时加入H2O2的目的是___________________(用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是_________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为_____________,滴定终点观察到的现象为_________________。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会__________(填“偏高”“ 偏低”“ 不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Fe 2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①向滤液中加入___________使其充分反应;②滴加1.0mol·L-1的氢氧化钠,调节3.2≤pH<5.9,使___________沉淀完全;③过滤;④向滤液中滴加1.0 mol·L-1的氢氧化钠,调节pH为________≤pH≤_______,使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
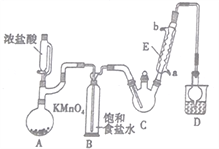
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________,引起的后果是_________________。
(3)仪器A中发生反应的离子方程式为____________________。
(4)该装置C可采用_______________,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________,装置D烧杯中的试剂是_______________。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________(填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A为两种金属组成的合金,发生如下图所示的变化:

试填写以下空白:
(1)合金A由________和________组成。
(2)写出下列变化的离子方程式。
C→E______________________________________________________________;
D→F______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com