
科目: 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )

A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀最严重区域应该是生锈最多的区域
C. 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-===4OH-
D. 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )

A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
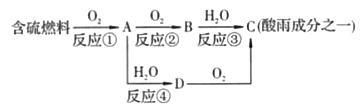
回答下列问题:
①酸雨的pH________(填“>”“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为___________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________,反应中氧化剂是___________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】烃A是一种重要的化工原料。已知A在标准状况下的密度为1.25 g·L-1,B可发生银镜反应。它们之间的转化关系如图:
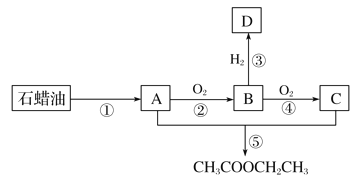
请回答:
(1)有机物B中含有的官能团名称是_______________________________________________。
(2)第⑤步发生加成反应,该反应的化学方程式是_________________________________。
(3)将金属钠与有机物D反应所得的少量产物溶于水,滴加2滴酚酞溶液,水溶液显红色,其原因是__________________(用化学方程式表示)。
(4)下列说法正确的是________。
A.有机物A与D在一定条件下可反应生成乙醚[(CH3CH2)2O]
B.用新制碱性氢氧化铜悬浊液无法区分有机物B、C和D
C.通过直接蒸馏乙酸乙酯和有机物C的混合物,可分离得到纯的乙酸乙酯
D.相同条件下乙酸乙酯在氢氧化钠溶液中水解较在稀硫酸中更完全
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO![]() 、SiO
、SiO![]() 、SO
、SO![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是( )
A. 溶液X中一定含有Na+、Cl-和SiO![]()
B. 溶液X中一定不含Ca2+、Br-
C. 为确定溶液X中是否含有SO![]() ,可取溶液2,加入BaCl2溶液
,可取溶液2,加入BaCl2溶液
D. 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变成血红色
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究不溶性盐X(仅含四种元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X的组成元素为H、O和______(用元素符号表示),化学式为________________。
(2)写出经一步反应能得到X的化学方程式(要求非氧化还原反应)
_______________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO![]()
下列说法正确的是( )
A. NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B. 充电过程中OH-从阳极向阴极迁移
C. 充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D. NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,充入一定量的反应物A,反应![]() 达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则下列判断正确的是( )
达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则下列判断正确的是( )
A. ![]() B. 物质A的转化率降低
B. 物质A的转化率降低
C. 物质B的质量增加 D. 平衡向正反应方向移动了
查看答案和解析>>
科目: 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )
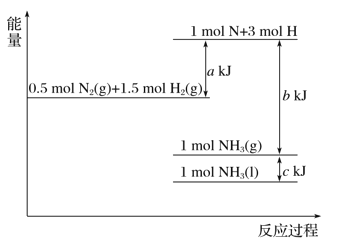
A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com