
科目: 来源: 题型:
【题目】煤是重要能源。燃煤会释放SO2、CO等有毒气体。消除有毒气体的研究和实践从未停止。完成下列填空:
I.用CaSO4消除CO。CaSO4和CO可发生如下两个反应:
反应①:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)+175.6kJ
CaS(s)+4CO2(g)+175.6kJ
反应②:CaSO4(s)+4CO(g)![]() CaO(s)+SO2(g)+CO2(g)—218.4kJ
CaO(s)+SO2(g)+CO2(g)—218.4kJ
(1)写出反应①的平衡常数表达式:_____________;一定条件下的密闭容器中,两反应均达平衡后,若使反应①K的减小,需要改变的反应条件是______________,则反应②的K___________(选填编号)、反应①的v(CO2)正__________(选填编号)。
a. 增大 b. 减小 c. 不变 d. 无法判断
(2)补全下图中反应②的能量变化示意图_______________(即,注明生成物能量的大致位置及反应热效应数值)

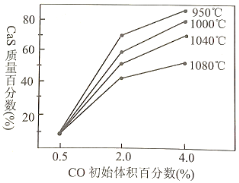
(3)下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低SO2生成量的措施___________________________________。
II. Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:8H2O + FeS2+ 7Fe2(SO4)3→15FeSO4+ 8H2SO4
(4)标出电子转移的数目和方向________;还原产物是_______。
(5)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:___________________________。
(6)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入___________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
查看答案和解析>>
科目: 来源: 题型:
【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量(mol) | 1.8 | 2.0 | 1.2 |
①反应达到平衡时,CO的转化率为_______,5分钟内用H2表示的速率为________
②该反应的平衡常数K=__________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CO、H2的浓度之比为1:2
E.单位时间内,每生成1mol H2消耗2mol CH3OH
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正 __________v逆(填“ >” < ”或“= ”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,五种含有同种金属元素的单质或其化合物,能按如图箭头方向实现一步转化(不含电解),该金属元素可能是( )

①Fe ②Cu ③Al ④Na
A. ①② B. ②④
C. ①③ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。

查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 分别取样:
分别取样:![]() 测得溶液显弱酸性;
测得溶液显弱酸性;![]() 滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是
滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是
A. 焰色反应 B. NaOH溶液(加热)
C. ![]() 酸化
酸化![]() 溶液 D.
溶液 D. ![]() 气体
气体
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化
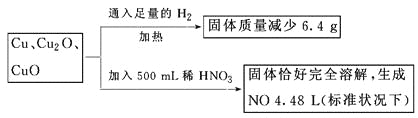
则转化过程中所加稀HNO3的物质的量浓度为
A. 4.4 mol·L-1 B. 3.6 mol·L-1 C. 4.0 mol·L-1 D. 3.2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某制碱厂的生产流程示意图如下:

下列分析正确的是( )
A. 该制碱法是侯氏制碱法 B. 反应①中包含复分解反应
C. X中只含有Ca2+和Cl— D. 理论上,生产过程中无需补充CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg![]() MgCl2+2Rb(g),下列说法正确的是( )
MgCl2+2Rb(g),下列说法正确的是( )
A.镁的金属活动性比铷强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性比RbCl弱
D.Rb单质比RbCl更稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com