
科目: 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是_______________________;
Y与过量浓硝酸反应后溶液中含有的盐的化学式为__________。
(2)某溶液中含有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________(填字母)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________________;
操作Ⅱ的方法为________________________________________________________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)_______________。
③请完成生成FeCO3沉淀的离子方程式:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
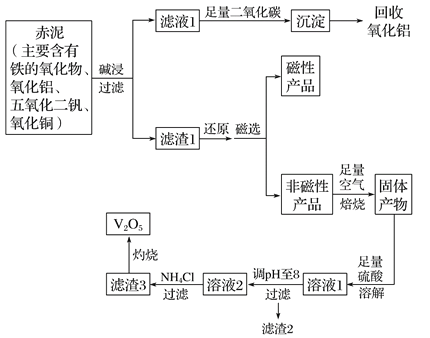
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. CO(g)的燃烧热ΔH=-283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
D. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(l) ΔH=-242 kJ·mol-1
O2(g)===H2O(l) ΔH=-242 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如图实验:

现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的![]() 置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是__________________________________。
(2)装置a和c的作用分别是________和________(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)滴定达终点时的现象是_________________________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_______________________。
(5)通过计算可知,该黄铜矿的纯度为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2===4AlCl3+3O2。
回答以下问题:
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2△,AlCl3+X↑,则气体X可能是
___________________________________________________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式:______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为

A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应是化学实验现象的本质,根据描述回答下列问题:
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2不能看到沉淀的有 (填序号).
①Cl2②NaOH③HCl④FeCl3溶液⑤CO2⑥H2S⑦NH3⑧NaClO溶液
(2)图中A、B、C之间有以下的转化关系(副产物已略去);
![]()
则下列说法正确的是
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuSO4
错误观点 | “否定的”离子方程式 | |
① | 所有的离子方程式均可以表示一类化学反应 |
|
② | 所有酸碱中和反应均可表示为 H++OH﹣═H2O |
|
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 邻羟基苯甲醛的沸点比对羟基苯甲醛的高
B. 基态碳原子的最外层电子排布图:![]()
C. 原子核外价电子排布式分别为3s1和3s23p5两种元素,不能形成AB2型化合物
D. 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com