
科目: 来源: 题型:
【题目】实验室用MnO2和浓盐酸制氯气的反应为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
(1)被氧化的氯化氢的质量为________________________________________________。
(2)转移电子的物质的量为________________________________________________。
(3)纺织工业中常用氯气作漂白剂,漂白布匹后,过量的氯需要除去,通常可用Na2SO3作“脱氯剂”,脱氯后的产物为Na2SO4,氯变为-1价。若把本题中产生的Cl2完全转化,需要Na2SO3的质量为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨作为重要化工原料,被大量应用于工业生产。氨在不同催化剂条件下可发生下列两个反应:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6kJ·molˉ1
2N2(g) +6H2O(g) △H=-1266.6kJ·molˉ1
(1)写出NO分解生成N2与O2的热化学方程式:___________________________。
(2)反应I在容积固定的密闭容器中进行,容器内部分物质的物质的量浓度如下表:
时间 浓度 | c(NH3)/mol/Ll | c((O2)/mol/L | c(NO)/ mol/L |
第 0 min | 0.8 | 1.6 | 0 |
第 2 min | 0.3 | 0.975 | 0.5 |
第 3 niin | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应从开始到第2min时,v(H2O)=__________________。
②在第3min时,改变的反应条件可能是_________(填选项字母)。
A.使用催化剂 B.臧小压强 C.升高温度 D.增加O2的浓度
③该反应达到平衡状态的标志是___________(填选项字母)。
A.在恒温恒容的容器中,混合气体的密度不再变化
B.单位时间内消耗nmolNO的同时消耗nmolNH3
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
(3)①若在容积为2L的密闭容器中充入8molNH3(g)和6molO2(g),发生反应II。保持其他条件不变,在相同时间内测得c(N2)与温度的关系如图所示。则T1℃下,NH3的平衡转化率为___。
②图中a、c两点对应的容器内部压强Pa____Pc(填“>”、“<”或“=”)

(4)氨气可用于生成硝酸铵化肥。25℃时,已知NH3·H2O的电离常数Kb=1.8×10-5,则硝酸铵在此温度下发生水解反应的平衡常数Kh=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
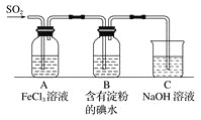
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下

回答下列问题:
(1)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是__________;金属镍溶解的离子方程式为__________________________________________。
(2)“除铁”时H2O2的作用是___________________,加入碳酸钠的目的是__________________________________________。
(3)“除铜”时,反应的离子方程式为_____________________________________,若用Na2S代替H2S除铜,优点是__________。
(4)已知除钙镁过程在陶瓷容器中进行,NaF的实际用量不能过多的理由为_____________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为_______,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤10-5 mol/L;lg2=0.30)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电化学装置的说法正确的是

A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中说明氨气具有还原性和碱性的是( )
A. 2NH3+3CuO=3Cu+N2+3H2O
B. 8NH3+3Cl3=6NH4Cl+N2
C. 4NH3+6NO![]() 5N2+6H2O
5N2+6H2O
D. NH3+HCl=NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】将3.72 g由金属钠、氧化钠和过氧化钠组成的混合物与足量水反应,在标准状况下得到672 mL混合气体。将该混合气体用电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比是( )
A. 3∶2∶1 B. 4∶2∶1 C. 2∶1∶1 D. 1∶1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色固体,易溶于酸,难溶于水、乙醇等溶剂。
(1)某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为__________________(填仪器接口的字母编号,装置可重复使用);实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后,先想灭酒精灯,待反应管冷却至室温后,停止通入气体;④拆除装置,取出产物。实验步骤③的操作目的是______________________。

(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+,在碱性环境下制取CaO2·8H2O的装置如下:

①仪器C的名称____________;反应结束后,经__________(填操作名称)、洗涤、低温烘干可获得CaO2·8H2O。
②装置A中发生反应的化学方程式为_____________;装置B中用冰水浴控制温度,其可能原因是______________________________。
③测定产品中CaO2·8H2O的含量的实验步骤如下:
步骤一:准确称取a g产品放入锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴___________(作指示剂)。
步骤三:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体枳为VmL。则CaO2·8H2O的质量分数为____(用含字母的式子表示)。 [已知:I2+2S2O32-=2I-+ S4O62-]
查看答案和解析>>
科目: 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
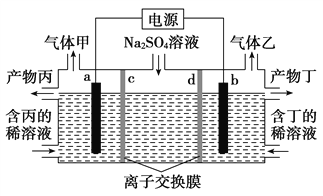
A. a极与电源的负极相连
B. 产物丙为硫酸
C. 离子交换膜d为阴离子交换膜
D. a电极反应式:2H2O+2e-===H2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com