
科目: 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空。
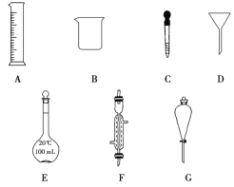
(1)写出仪器名称:D________,E________。
(2)下列实验操作中用到仪器G的是________(填下列选项的编号字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
(3)实验室配制100 mL 0.5 mol/L的盐酸。
①下列关于仪器E的使用方法中,正确的是________(填下列选项的编号字母)。
a.使用前应检查是否漏液
b.使用前必须烘干
c.不能用作物质反应或溶解的容器
d.热溶液可直接转移到其中
②配制该溶液需用10 mol/L的浓盐酸________mL。取用该体积盐酸时,需要用到上述仪器中的A和________(填仪器的编号字母)。
③下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。
a.没有将洗涤液转移到容量瓶中
b.转移过程中有少量溶液溅出
c.摇匀后,液面下降,补充水
d.定容时俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)若三者c(H+)相同时,物质的量浓度由大到小的顺序是____________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是__________。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是__________________。
(5)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是____________。
(6)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为_______。反应所需时间的长短关系是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010mol·L-1氨水、0.1mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:__________________________________。
②乙取出10mL0.010mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是_____。
(II)(1)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于很多人来说,喝茶是人生的一大乐事,茶叶中含有少量的咖啡因。咖啡因具有扩张血管、刺激心脑等作用,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。其结构简式如图所示。

实验室可通过下列简单方法从茶叶中提取咖啡因:

(1)咖啡因的分子式为___________。
(2)步骤1浸泡茶叶所用的溶剂最好为___________(填序号)。
A.水 B.乙醇 C.石油醚
(3)步骤1、步骤4所进行的操作或方法分别是______、______。
查看答案和解析>>
科目: 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。已知:AlN+NaOH+H2O═NaAlO2+NH3↑
【方案1】取一定量的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去)。

(1)如图1,C装置中球形干燥管的作用是______。
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。接下来的实验操作是_______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是____________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见________________。
【方案2】用图2装置测定mg样品中A1N的纯度(部分夹持装置已略去)。

(4)为测定生成气体的体积,量气装置中的X液体可以是_____。(填字母序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.C6H6
(5)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则AlN的质量分数是______。若将a处胶管用弹簧夹夹住,并把分液漏斗上口导管拨开,其它操作均同上,则最终测定的结果将________(填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是
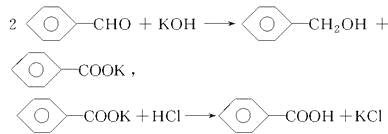
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
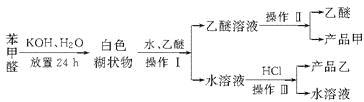
试根据上述信息,判断以下说法错误的是( )
A. 操作Ⅰ是萃取分液
B. 乙醚溶液中所溶解的主要成分是苯甲醇
C. 操作Ⅱ蒸馏所得产品甲是苯甲醇
D. 操作Ⅲ过滤得到产品乙是苯甲酸钾
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族;Y、Z同周期;X、Y、Z三种元素形成一种化合物M,25 ℃时,0.1 molL-1的M溶液中 =1.0×10-12。下列说法正确的是
=1.0×10-12。下列说法正确的是
A. 简单离子半径:Y<Z<W
B. X分別与Z、W形成的化合物中,所含化学键类型相同
C. X、Y形成的最简单化合物的电子式为![]()
D. Z分別与X、W均可形成具有漂白性的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com