
科目: 来源: 题型:
【题目】某无色溶液里只含有下列7种离子中的某几种:Mg2+ 、H+ 、Ag+ 、Na+ 、Cl- 、HCO3- 、OH- 。已知:该溶液能跟金属铝反应,且放出氢气。试回答:
(1)若铝跟溶液反应后只有AlO2-生成,则原溶液一定含有的大量离子是_______ ,发生该反应的离子方程式是__________;还可能含有离子是__________。
(2)若铝跟溶液反应后只有Al3+生成,则原溶液中一定不能大量含有的离子是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:如下:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:

回答下列问题:
(1)“碱浸”时发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,________________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。___________________________
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为__________________。
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其放电时,正极的电极反应式为__________________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:
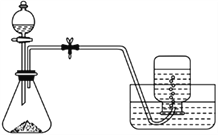
①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种化合物,其中A、B、C焰色反应均为黄色,而D的焰色反应为紫色,A、C和盐酸反应均得到B,将固体A加热分解可得到C,若在C的溶液中通入一种无色无味气体,又可得到A的溶液;若D的溶液滴加到FeCl2溶液中,先出现白色沉淀迅速变成灰绿色,最后变成红褐色沉淀E。
(1)试推断各物质的化学式A:_____、B:_____、C:_______、D:_______、E:______
(2)按要求写出下列方程式:
①A与盐酸反应的离子方程式:__________________________;
②A固体受热分解的化学方程式:______________________;
③D溶液滴加到FeCl2溶液中出现白色沉淀及最后变成红褐色沉淀的相关化学方程式:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)FeCl3溶液中加入铁粉,溶液由___色变为___色,该反应的离子方程式为______;
(2)除去FeCl3溶液中混有的FeCl2需向溶液中通入______(填物质名称),该反应的离子方程式为______;
(3)在Fe3O4 +4CO![]() 3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将铜片放入0.1mol·L-1FeCl3溶液中,反应一段时间后取出铜片,溶液中![]() ,则反应后溶液中
,则反应后溶液中![]() 与
与![]() 的物质的量之比为 ( )
的物质的量之比为 ( )
A. 3:2 B. 3:4 C. 3:5 D. 4:3
查看答案和解析>>
科目: 来源: 题型:
【题目】己知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3,杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体VmL。下列说法正确的是( )

A. 铜电极连接电源正极 B. 铜的相对原子质量的计算式是![]()
C. 黑色粉末X是铁粉 D. 石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,将0.2 molC(S)和0.3 mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)![]() CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
A. 从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 molL-1min-1
B. 达平衡时压强变为原来的7/6
C. 此温度下该反应的平衡常数为0.0125
D. 若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中书写正确的一组是( )
①.制取漂白液的反应原理: Cl2+2OH-=== Cl-+ClO-+ H2O
②.铁粉加入到三氯化铁溶液中: Fe3+ +Fe === 2Fe2+
③.NaHCO3溶液中加入稀盐酸:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
④.向澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=== CaCO3↓+H2O
⑤.硫酸铝溶液与足量的氨水混合反应: Al3+ + 4OH- === AlO2-+ H2O
⑥.过量氯水与FeCl2溶液作用: 2Fe2++Cl2 ==2 Fe3++2Cl-
A. ①②③ B. ③⑥ C. ①③⑥ D. ①④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水常用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是 ( )
A. AgNO3 B. FeCl2
C. NaHSO3 D. NaNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com