
科目: 来源: 题型:
【题目】用双线桥及单线桥表示反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 电子转移情况。
双线桥________________________________________。
单线桥________________________________________。
该反应中氧化剂是:_______。若有4molHNO3参加反应,转移电子的物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是

A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是
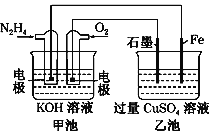
A. 乙池中Fe电极上发生氧化反应
B. 乙池中石墨电极上发生的反应可写为4OH--4e-===2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】用如下图装置实验,下列实验现象预期及相应结论均正确的是
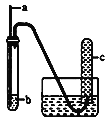
a | b | 实验现象预期 | 结论 | |
A | 铁丝 | HCl酸化的H2O2 | c中收集到无色气体 | 铁丝催化H2O2分解 |
B | 铜丝 | 浓硝酸 | c中收集到红棕色气体 | 硝酸有强氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 木条 | 浓硫酸 | 木条变黑 | 浓硫酸有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学化学常用于混合物分离和提纯的装置,请根据装置回答问题:
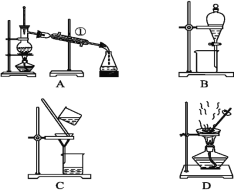
(1)从氯化钾溶液中得到氯化钾固体,选择装置____(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为__________。
(3)装置B在分液时为使液体顺利下滴,应进行的具体操作是__________________________
(4)海水中蕴藏着丰富的资源,取少量海水按如下流程进行实验:
海水![]() 粗盐
粗盐![]() 食盐水
食盐水![]() 氯化钠晶体
氯化钠晶体
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是____(填写字母序号)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com