
科目: 来源: 题型:
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是
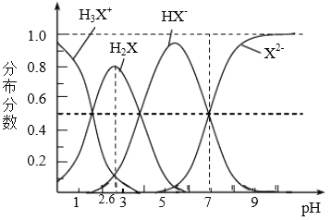
A. 溶液pH由l升至2.6时主要存在的反应是:H3X++OH-=H2X+H20
B. H2X的第二步电离平衡常数Ka2(H2X)为10-4
C. NaHX溶液中c(H+)<c(OH-)
D. 当溶液呈中性时:c(Na+)=2c(X2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应与能量以及化学平衡原理是中学化学学习的重要内容。请回答下列问题:
⑴己知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是_________________________________。
⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是_____________,A是______________。

⑶25 ℃时,向含a mol NH4Cl的水溶液滴加b L氨水后溶液呈中性,则所滴加氨水的浓度为________mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5)
⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H_______0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是_________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
查看答案和解析>>
科目: 来源: 题型:
【题目】锌焙砂是锌精矿经焙烧后所得的产物,以锌焙砂为原料制取金属锌的流程如图所示。
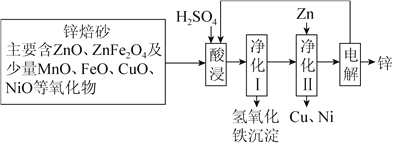
已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。
②碱性条件下Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅵ)。
请回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=________mol·L-1(已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38)。
(3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式_____________________________;
电解时不断补充电解液的目的是_________________________。
(4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】往含I一和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3
溶液的体积V( AgN03)的关系如图所示。已知:Ksp(AgCl)=1.8×l0-10, Ksp( AgI) =l.5xl0-16,则原溶液中c(I一)/c(Cl-)的比值为

A. (V2- Vl)/Vl B. Vl/V2 C. Vl/( V2- Vl) D. V2/Vl
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法不正确的是( )

A. 醋酸的电离程度:a<b<c
B. 溶液中c(H+):b>a>c
C. a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-)
D. 从b点到c点,溶液中![]() 的比值减小
的比值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com