
科目: 来源: 题型:
【题目】12 mL 0.1 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A. +2 B. +3 C. +4 D. +5
查看答案和解析>>
科目: 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
C. 生成标准状况下NO气体的体积为![]() L
L
D. 与合金反应反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是
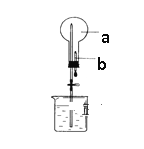
A. a为Cl2气体,b为饱和NaCl溶液
B. a为NH3气体,b为盐酸溶液
C. a为CO2气体,b为浓NaOH溶液
D. a为HCl气体,b为H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】[Fe(CN)6]3可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是

A. 电解时阳极反应式为[Fe(CN)6]4e![]() [Fe(CN)6]3
[Fe(CN)6]3
B. 电解时阴极反应式为2HCO3-+2e![]() H2↑+2CO32-
H2↑+2CO32-
C. 当电解过程中有22.4 L标准状况下的H2生成时,溶液中有32 g S析出(溶解忽略不计)
D. 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D.
⑴写出下列物质的化学式:B______E______D______
⑵写出A→C的化学方程式,并标出电子转移的方向和数目:__________。
⑶写出C→D的离子方程式:_______________
⑷写出化学方程式:E+B![]() D+C+O2↑:_____________.
D+C+O2↑:_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
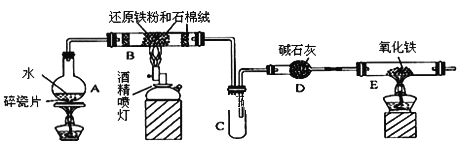
(1)装置B中发生反应的化学方程式是________________________________;
(2)装置E中的现象是______________________________________________。
(3)装置C中右侧导管为什么既不插入试管底部,又不只进入试管一点点,其主要原因是___________.
(4)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①步骤一中通入足量Cl2发生反应的离子方程式为_______________________________________。
②步骤二,从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括______________.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等,下列说法正确的是

A. X的相对分子质量等于Y的相对分子质量
B. X的相对分子质量比Y的相对分子质量小
C. 气体的体积:V(X) >V(H2)>V(Y)
D. 物质的质量:n(X)< n(H2) <n(Y)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,1mol N2和3mol H2混合后反应,达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则氮气的转化率为( )
A. 20% B. 30% C. 40% D. 50%
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρgcm-3,溶质的质量分数为![]() ,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
A. ![]()
B. ![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5![]()
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c (Cl-)>c(NH4+)>c (OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com