
科目: 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质, C、F是无色无味的气体,H是白色沉淀,.
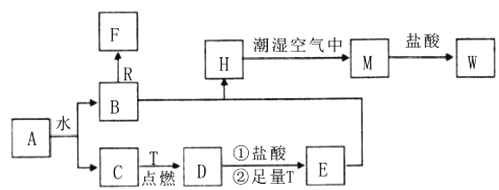
(1)H在潮湿空气中变成M的实验现象是______________,化学方程式为________。
(2)A和水反应生成B和C的离子方程式为___________________________,由此反应可知A有作为_________的用途。
(3)步骤①的离子方程式_________________________,步骤②后的离子方程式___________________请写出检验W溶液中主要阳离子所需要的试剂:_____。
(4)B和R在溶液中反应生成F的离子方程式为_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
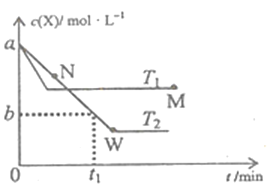
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
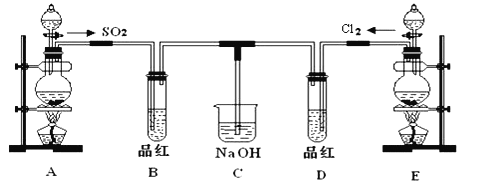
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是__________.
(2)实验室用装置E制备Cl2,其反应的化学方程式为__________;若有8mol的HCl参加反应,则转移的电子总数为__________.
(3)该装置中氢氧化钠溶液的作用是__________
(4)通气后B、D两个试管中的现象分别为B:________D:________.停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:______________D:___________.
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红的颜色_________.请你分析该现象的原因(用化学方程式表示)__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】①Cu丝 ②Cl2 ③Al2(SO4)3溶液 ④蔗糖 ⑤浓硝酸⑥Ca(OH)2⑦NH4Cl⑧CO2 ⑨氨水
请用以上相应的数字编号和化学用语回答问题:
(1)属于电解质的是__________;属于非电解质的是__________.
(2)实验室制取氨气的化学反应方程式_______________________.
(3)工业制漂白粉的化学反应方程式__________________________.
(4)实验室制Al(OH)3的离子方程式______________________________________________________
(5)①和⑤的化学方程式并用双线桥标出电子转移__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2LNO和11.2LO2混合后气体的分子总数为NA
B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度不变的条件下,恒定的容器中进行下列反应:N2O42NO2,若N2O4的浓度由0.1mol/L降到0.07mol/L要用10s,那么N2O4的浓度从0.07mol/L降到0.04mol/L时,所用时间( )
A. 等于10s B. 等于5s C. 大于10s D. 小于10s
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
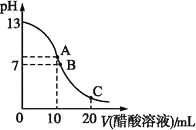
A. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. 在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1) NH2OH的电子式为________________。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3__________(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为______________________。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:

①该实验适宜的加热方式为______________。
②装置中导管X的作用是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向NaOH和Na2CO3的混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如下图所示。下列判断正确的是

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为CO32- +2H+ = CO2 ↑+H2O
C. a = 0.3
D. 原混合溶液中NaOH和Na2CO3的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com