
科目: 来源: 题型:
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制硫酸铜的方法很多:
(1)方法一:用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________________。
(2)方法二:实验证明,铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为_____________________________。
(3)以上两种方法________(填“前”或“后”)者好,原因是________________________。
(4)方法三:用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
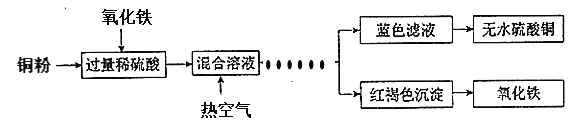
稀硫酸和氧化铁反应的离子方程式是_____________________________(反应①);铜和上述反应(反应①)得到的物质反应的离子方程式是_________________________;向混合溶液中通入热空气的目的是_______________________________;分离蓝色滤液和红褐色沉淀的实验操作是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
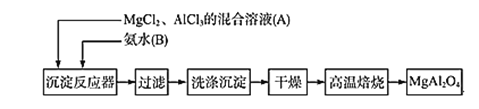
(1)写出AlCl3与氨水反应的化学反应方程式 _________________________________。
(2)判断流程中沉淀是否洗净的方法是__________________________________________,高温焙烧时,用于盛放固体的仪器名称是________________。
Ⅱ.无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
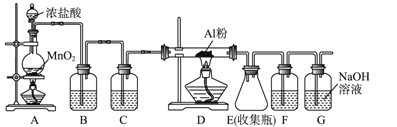
(3)其中装置A用来制备氯气,写出其化学反应方程式______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的离子方程式:____________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案_______(填“可行”,“不可行”),理由是__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.(1)现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式 _____________________________________。
②与0.1 mol·L-1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:__________。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是______________________。
II.A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
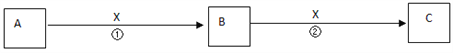
(1)若X是氧气,则A不可能 ______(填序号) A.C B.SiC.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)________________。检验B溶液中阳离子的操作方法是________________________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
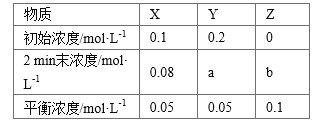
下列说法正确的是
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D. 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目: 来源: 题型:
【题目】葡萄酒常用焦亚硫酸钠(Na2S2O5)作抗氧化剂。某兴趣小组用下图装置(夹持装置略)测定某葡萄酒中抗氧化剂的残留量(以游离的SO 2计算),方案如下:向B中加入300.00mL葡萄酒和适量的稀硫酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2后,将C中液体转移至小烧杯中,向烧杯内逐滴加入BaCl2溶液至沉淀量不再增加,过滤出沉淀,经洗涤、干燥后,称得固体的质量为0.2796g,则该葡萄酒中SO2的含量为
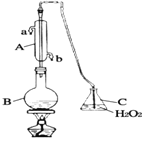
A. 0.256 g/L B. 0.04 g/L C. 0.24 g/L D. 0.0768 g/L
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是( )

A. Na2O2中阴阳离子数目之比为1∶1
B. 反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑
C. ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
D. 反应③转移电子的物质的量为0.1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中能说明亚硝酸是弱电解质的是( )
A. 用![]() 溶液做导电试验,灯光较暗
溶液做导电试验,灯光较暗
B. ![]() 是共价化合物
是共价化合物
C. 亚硝酸不与氯化钠反应
D. 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】把2.3g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A. 7.2g B. 3.6g C. 2.3g D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com