
科目: 来源: 题型:
【题目】已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为![]()
C. 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D. 20℃时,饱和NaCl溶液的溶解度![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列的M、N、P物质,其中可以成立的是
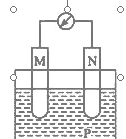
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸银溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g)![]() 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A. 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3
B. 平衡混合物体积是反应开始前的3/5
C. 平衡混合物中各物质的量浓度相等
D. 单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2O2是呼吸面具中常用的供氧剂,下列关于Na2O2的叙述正确的是( )
A. Na2O2中阴、阳离子的个数比为1:1
B. Na2O2分别与水、CO2反应,产生相同量的O2时,需要水和CO2的物质的量相等
C. Na2O2与CO2反应过程中,只做氧化剂
D. Na2O2与SO2的漂白原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③
C.⑤②④①③ D.⑤④②①③
(2)步骤①中所用的玻璃仪器有烧杯、______________、_____________。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是__________
Ⅱ.碘是人体所需的必需元素,海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海洋植物中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
(1)上述过程灼烧海藻是在____________(填仪器名称)中进行。
(2)上述步骤②中是加入了氯水,利用氯水中的Cl2把I-氧化为I2,请写出该反应的离子方程式_____________。
(3)上述步骤③中加入了CCl4后进行振荡,振荡后静置分层,上层______色,下层_______色。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室利用二氧化锰和浓盐酸反应制取Cl2,化学方程式如下: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用单线桥标出该反应电子转移的方向和数目___________,该反应的氧化产物是___________。
(2)其中氧化剂与还原剂的物质的量之比是___________;若实验中有87g的MnO2完全反应,则制得的Cl2在标况下的体积是___________L。
Ⅱ.盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2 g/mL,质量分数为36.5%的浓盐酸配制250mL 3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为________mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、___________、___________。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是____________。
A.量取浓盐酸时俯视刻度线 B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线 D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)实验室常用石灰石与盐酸反应制取CO2,请写出该反应的离子方程式__________。
(2)实验室常用锌粒与稀硫酸制取氢气,请写出该反应的离子方程式__________。
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,请写出制备氢氧化铁胶体的化学方程式___________。
(2)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这表明Fe(OH)3胶体微粒带 _________ (填“正”或“负”)电荷。
(3)取少量Fe(OH)3 胶体于试管中,逐滴加入硫酸至过量,可看到的现象是____________。
(4)3.4gOH-中有_________mol OH-,其含有的电子数是_______个(阿伏加德罗常数用NA表示)。在同温同压下CH4和N2组成的混合气体对H2的相对密度为10,则混合气体中CH4与N2的体积比为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法不正确的是

A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N为电池的正极
C. 充电时,阴极反应为:Li+ +e-=Li
D. 充电时,接线柱A应与外接电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com