
科目: 来源: 题型:
【题目】镁、铝、铁三种金属,分别与足量的同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则反应中( )
A. 金属失去电子数目相等 B. 消耗金属的质量相等
C. 消耗金属的物质的量相等 D. 消耗的HCl的量不相等
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料。某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。回答下列有关问题。
(背景素材)Ⅰ.NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2;
II.亚硝酸具有一定的氧化性和还原性,酸性条件下:Ca(NO2)2能将I-氧化为I2;
Ⅲ.I2+2S2O32—=2I-+S4O62—
(制备Ca(NO2)2)该小组设计的制备装置如图所示(夹持装置略去)。
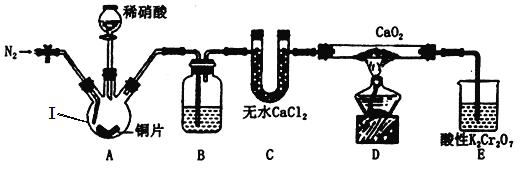
(1)仪器Ⅰ的名称是___________________;B中盛装的试剂是____________________。
(2)制备过程有关操作如下,正确顺序为_______、c、_______、_______、_______、_______。
a.向装置中通入N2 b.向仪器Ⅰ中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入N2 f.关闭分液漏斗旋塞
(3)装置E中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3—,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为__________________________。
(4)整个过程持续通N2的作用是______________、_____________、____________。
(测定Ca(NO2)2的纯度)该小组测定产品中Ca(NO2)2纯度的方法如下:a.称取mg产品、溶解、定容至250mL;b.移取25.00mL溶液于锥形瓶中,加入过量的V1 mLc1mol/L的KI溶液并酸化;c.以淀粉为指示剂,用c2mol/L的Na2S2O3溶液滴定。进行三次平行实验,消耗标准液体积平均值为V2 mL。
(5)测定过程所需仪器在使用前必须检查是否漏液的有______________________。
(6)该产品中Ca(NO2)2的质量分数为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知草酸(H2C2O4)可使H2SO4酸化的KMnO4溶液褪色,请回答以下问题:
①在该反应中0.2mol高锰酸钾可得到1mol电子,该反应的还原产物为________(写化学式)
②请补全并配平该反应方程式:
___H2C2O4+ KMnO4+ H2SO4 → K2SO4+ + CO2↑ + H2O
(2)某溶液中可能含有以下离子:Na+、K+、Fe3+、CO32-、SO42-、Cl-,现进行如下实验:

根据实验现象回答:
该溶液中一定含有的离子是______________;一定不含有的离子是____________;无法确定的离子是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(l)天然气和CO2通入聚焦太阳能反应器,发生反应CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=_______________(用含a、b、c的代数式表示)kJ/mol。
2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=_______________(用含a、b、c的代数式表示)kJ/mol。
(2)CO2和H2可以合成二甲醚(CH3OCH3)。二甲醚是一种绿色环保型能源,以稀硫酸为电解质溶液,若某二甲醚空气燃料电池每消耗l mol CH3OCH3,电路中通过9 mol电子,则该电池效率η为___________。(提示:电池效率等于电路中通过的电子数与电池反应中转移电子总数之比)
(3)325K时,在恒容密闭容器中充入一定量NO2 ,发生反应:2NO2(g)![]() N2 O4(g)。
N2 O4(g)。
①NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为:____________;
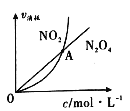
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
② 能够说明上述反应已经达到平衡状态的有__________________;
a.NO2和N2 O4的物质的量相等 b.体系颜色不再变化
c.容器内混合气体的密度不再改变 d.容器内气体压强不发生变化
③若达到平衡后容器内混合气体的平均相对分子质量为57.5。平衡时NO2的转化率为_____。
(4)实验中多余的SO2可以用氢氧化钠溶液吸收。常温下H2SO3的Ka1=1.3×10-2、Ka2=6.6×10-8。
①室温下pH=3的亚硫酸溶液,下列判断正确的是_______________。
a.溶液中c(H2SO3)>c(SO32—) b.溶液中c(SO32—):c(HSO3—)=6.6×10-5
c.溶液中氢离子数目为6.02×1020个 d.加入等体积pH=3的硫酸溶液,亚硫酸的电离平衡不移动
②常温下,用含1mol氢氧化钠的稀溶液吸收足量SO2气体,放出热量为QkJ,该反应的热化学方程式为_______
③若吸收液中c(HSO3—)=c(SO32—),则溶液中c(H+)=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列有关问题。
(1)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ | Cu2+ | Fe3+ | Al3+ | Fe2+ |
阴离子 | Cl- | CO32— | NO3— | SO42— | SiO32— |
某同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:原溶液中所含阳离子是___________________,阴离子是_____________________。
(2)光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
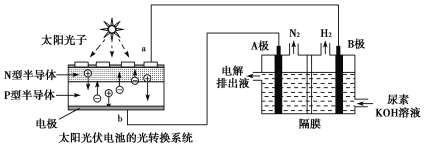
图1 图2
①图1中N型半导体为____________(填“正极”或“负极”)
②该系统工作时,A极的电极反应式为___________________________________________。
③若A极产生7.00gN2,则此时B极产生_____________LH2(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①月球上某矿石经处理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化学方程式为______。
②MgO与炭粉和氯气在一定条件下反应可制备MgCl2,尾气中的氯气可用足量冷的NaOH溶液完全吸收,则生成的盐为_________、_________(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:

①该反应为________反应(填“吸热”或“放热”)。
②若要使该反应的反应速率加快,下列措施可行的是________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(2)美国阿波罗宇宙飞船上使用了一种新型燃料电池,其构造如图所示,A、B两个电极均由多孔的碳块组成,该电池的正极反应式为:_______________________________。

(3)300 ℃时,将A和B两种气体混合于恒容密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),2 min末达到平衡。
2C(g)+2D(g),2 min末达到平衡。
①300℃时,该反应的平衡常数表达式为K=________。
②已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,1mol·L-1的HClO2和1mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法正确的是( )
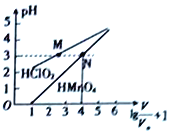
A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=1g![]()
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应进行到5min时,测得N2O5转化了20%,
4NO2(g)+O2(g)。反应进行到5min时,测得N2O5转化了20%,
(1)5min时,剩余N2O5的物质的量;
(2)前5min,v(NO2)为多少;
(3)5min时,N2O5的物质的量占混合气体总物质的量的百分比(保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com