
科目: 来源: 题型:
【题目】为了探究HCl、H2CO3和H2SiO3的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到实验目的(不必选用其他酸性物质)请回答下列问题:
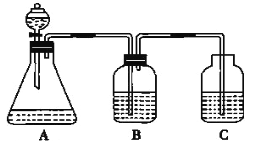
(1)锥形瓶中装有某种可溶性正盐溶液,则分液漏斗中所盛试剂应为_______。
(2)装置B中所盛的试剂是_______,其作用是_______。
(3)装置C中所盛的试剂是_______,C中所发生反应的离子方程式为_______。
(4)由此得出HCl、H2CO3、H2SiO3的酸性强弱顺序是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。

(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 0.1 mol Na2O2含有的离子总数为0.4NA
B. 常温常压下,18g H2O 所含的中子数为8NA
C. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D. 将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】锌与100mL 18.5molL-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲35.84L(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol/L,下列叙述不正确的是( )
A. 反应中共消耗1.8molH2SO4
B. 气体甲中SO2与H2的体积比为7:1
C. 反应中共消耗1.6molZn
D. 反应中共转移3.2mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,下列有关说法正确的是
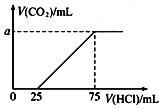
A. 原溶液中NaOH的物质的量为0.75 mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D. 纵坐标中a的数值为224
查看答案和解析>>
科目: 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
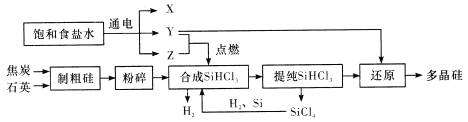
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在水玻璃中通入少量的CO2气体,充分反应后加热蒸干,再高温充分灼烧,冷却后所得的固体物质为()
A. Na2SiO3 B. Na2SiO3与Na2CO3
C. SiO2与Na2CO3 D. SiO2、Na2SiO3及Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +5/2O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+ ![]() O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1
C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G[ ]是一种医药中间体,它的一种合成路线如下:
]是一种医药中间体,它的一种合成路线如下:

已知:
请回答下列问题:
(1)A的名称是_____________。
(2)B→C的反应条件为_____________。
A→B和D→E的反应类型分别是_____________、_____________。
(3)D在浓硫酸加热的条件下会生成一种含六元环的化合物,该化合物的结构简式为_____________。(4)H是一种高聚酯,D→H的化学方程式为_____________。
(5)下列关于化合物G的说法错误的是_____________。
A.G的分子式为C12H14O5
B.1molG与NaOH溶液加热最多消耗2molNaOH
C.一定条件下G发生消去反应生成的有机物存在顺反异构体
D.在一定条件下G能与HBr发生取代反应
(6)M是D的同分异构体,与D具有相同的官能团。则M可能的结构有____种。
(7)已知酚羟基不易与羧酸发生酯化反应,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯(![]() )的合成路线(其它试剂任选)。 __________________
)的合成路线(其它试剂任选)。 __________________
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
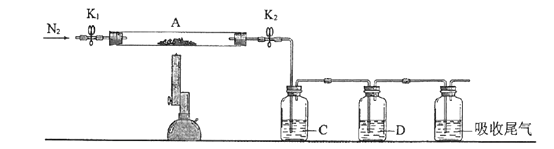
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
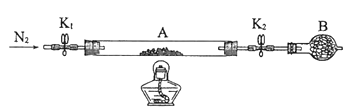
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com