
科目: 来源: 题型:
【题目】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
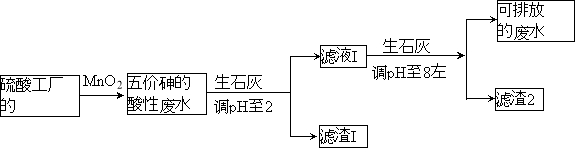
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
污染物 | H2SO4 | As |
废水浓度 | 29.4g/L | 1.6g·L-1 |
排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe ![]() H2
H2 ![]() Cu , ② CuO
Cu , ② CuO ![]() CuSO4
CuSO4 ![]() Cu 。
Cu 。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则对两者制得单质铜的量作比较,正确的是
A. 相等 B. ①多 C. ②多 D. 无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是未来最理想的新能源。
(1)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+_____![]() _____ +_____④2HgO
_____ +_____④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________。
(2)已知2H2(g) + O2(g) ==2H2O(l);△H=–571.6 kJ·![]()
C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ·![]() ,
,
试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
查看答案和解析>>
科目: 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:

(1)甲烷燃料电池的负极反应式______.
(2)石墨电极(C)的电极反应式为______.
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为______;丙装置中阴极析出铜的质量为______.
查看答案和解析>>
科目: 来源: 题型:
【题目】铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。已知:2Na2S2O3+I2→Na2S4O6+2NaI。完成下列填空:
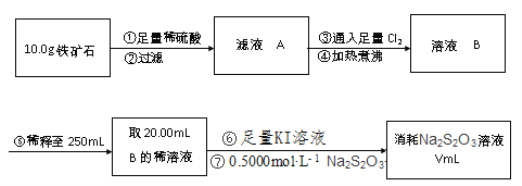
(1)步骤②用到的玻璃仪器除烧杯外,还有______。
(2)步骤③对应反应的离子方程式为______。
(3)步骤④中煮沸的作用是______。步骤⑤中必须用到的定量实验仪器是______。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的现象是______。若滴定过程中有空气进入,则测定结果______(选填“偏高”、“偏低”或“无影响”。
(5)若过程⑦中消耗0.5000mol/LNa2S2O3溶液20.00mL,则铁矿石中铁的百分含量为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
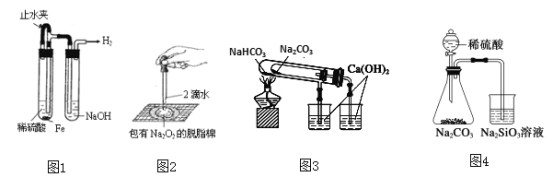
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
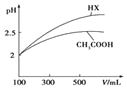
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的平衡常数表达式K=__________。该反应的正反应是______反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)能判断该反应是否达到化学平衡状态的依据是(_____)
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有__________(选填A、B、C、D)
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0. | 2 | 1 | 1 |
查看答案和解析>>
科目: 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
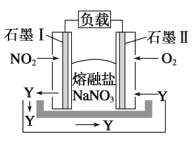
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com