
科目: 来源: 题型:
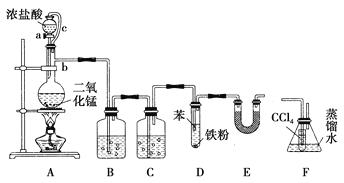
【题目】(题文)某实验小组利用如图装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)仪器b的名称是________。
(2)A装置中制备Cl2的离子方程式为______________________________。
(3)氯气在通入D之前需净化干燥,则装置C中所加试剂的名称为________。
(4)D中通入氯气后,先看到苯呈黄色,片刻试管液面上方有白雾产生,装置E的作用是________。
(5)为证明氯气和苯发生的是取代反应而不是加成反应,该小组用装置F说明,则装置F置于______之间(填字母),F中小试管内CCl4的作用是________,还需使用的试剂是________。
(6)D中混合物经过滤除铁、加水及NaOH溶液洗涤、无水氯化钙干燥等分离操作后得粗氯苯,粗氯苯中还含有的主要杂质为________,要进一步提纯,下列操作中必需的是________(填入正确选项前的字母)。
A.重结晶 B.分液 C.萃取 D.蒸馏
(7)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为________%(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:

(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
A.钝化铁片 B.检验Ba2+ C.干燥氨气 D.干燥氯气
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”或“抑制”)其水解.
(2)明矾可用于净水,原因是(用离子方程式表示):____________________
(3)泡沫灭火器灭火原理(用离子方程式表示)_____________________
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)______________
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42—和NO3—的相互分离:其中试剂1、2、4分别为

A. 硝酸银溶液 硝酸钡溶液 稀硝酸 B. 氯化钡溶液 稀硝酸 硝酸银溶液
C. 氢氧化钠溶液 硝酸银溶液 稀硝酸 D. 氯化钡溶液 硝酸银溶液 稀硝酸
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锰可用于饮料营养强氧化剂和媒染剂。其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺流程如图所示:
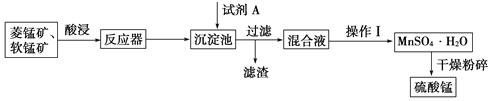
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
(2)各离子完全沉淀的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6。下列判断正确的是
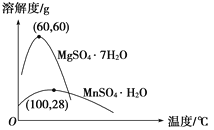
A. 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+
B. 试剂A应该选择氨水,目的是调节溶液的pH
C. 操作Ⅰ包括蒸发浓缩、冷却结晶、趁热过滤、洗涤等步骤,洗涤时可用稀硫酸作洗涤液
D. 通过操作Ⅰ得到MnSO4·H2O的过程中,包括蒸发结晶,在蒸发结晶时,温度应该高于60 ℃
查看答案和解析>>
科目: 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
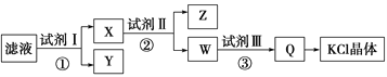
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是___________。
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为__________。
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶后,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式_______。
(4)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为___。
(5)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗) ![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式_______________________________________。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是

A. 可以选用方案Ⅰ分离NaCl中的I2
B. 方案Ⅰ中X物质不可能是受热易分解的物质
C. 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3
D. 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用MnO2和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得Cl2全部用石灰水吸收,可制得漂白粉的质量是
A. 14.3 g B. 25.4 g C. 28.6 g D. 50.8 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验室模拟以工业用菱铁矿(FeCO3)含碱式碳酸铜[Cu2(OH)2CO3]为原料制取纯净的FeCO3和氯化铜晶体(CuCl2·2H2O)的生产流程如下:
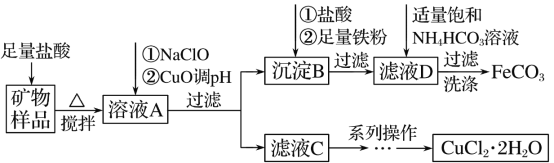
(1)盐酸溶解矿物样品时可能发生的离子方程式______。
(2)写出向溶液A中加入NaClO的离子方程式_________。
(3)向沉淀B中依次加入盐酸和铁粉时可能发生的离子方程式_________。
(4)处理滤液D时,除产生沉淀外,还产生无色气体,写出该反应的离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com