
科目: 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 向FeCl3溶液中加入铁粉:Fe3++Fe===2Fe2+
B. 向NaOH溶液中通入过量的CO2气体:OH﹣+CO2=== HCO3-
C. 铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
D. AlC13溶液中加入足量的氨水:Al3++3OH﹣===Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】将以下4份溶液分别置于如图的装置中,其它条件相同时,灯泡最亮的是
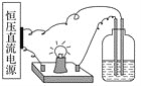
A. 100 mL 1 mol·L-1的盐酸
B. 100 mL 2 mol·L-1的蔗糖溶液
C. 100 mL 1 mol·L-1的醋酸溶液
D. 30 mL 1 mol·L-1的氯化铝溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸性溶液中只有Na+、CH3COO﹣、H+、OH﹣四种离子.则下列描述正确的是
A. 该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B. 该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C. 加入适量NaOH,溶液中离子浓度为c(CH3COO﹣)>c(Na+ )>c(OH﹣)>c(H+)
D. 加入适量氨水,c(CH3COO﹣)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
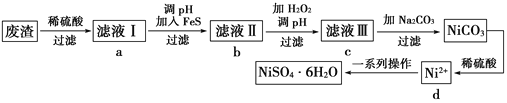
(1)向滤液Ⅰ中加入FeS是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为___________________________________。
(2)对滤液Ⅱ的操作,请回答:
①往滤液Ⅱ中加入H2O2的离子方程式为________________________________。
②调滤液ⅡpH的目的是除去Fe3+,其原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25 ℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=________________。
Fe(OH)3+3H+,已知25 ℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=________________。
③检验Fe3+是否除尽的操作和现象是__________________________________________。
(3)滤液Ⅲ中溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___________________。
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4·6H2O,请回答:
①在进行蒸发浓缩操作时,加热到___________________________(描述实验现象)时,则停止加热。
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的________位置(选填a、b、c、d)。
③如果得到产品的纯度不够,则应该进行________(填操作名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组数据中,前者一定比后者大的是( )
A. 相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液中水电离出的OH-浓度
B. 0.1 mol·L-1(NH4)2Fe(SO4)2溶液与0.1 mol·L-1(NH4)2SO4溶液中NH![]() 浓度
浓度
C. Na2CO3溶液中HCO![]() 和OH-的浓度
和OH-的浓度
D. 纯水在80 ℃和在常温下的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】我国要求在全国范围内形成全民节能减排氛围。下列有关做法中不符合这一要求的是( )
A、将煤液化、气化,提高燃料的燃烧效率
B、在汽车上安装汽车尾气催化转化装置,使之发生反应:
2CO+2NO![]() 2CO2+N2
2CO2+N2
C、在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢氧燃料电池汽车
D、在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是________,发生反应的离子方程式为________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是______________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组的同学分别对氯气和氯水的性质进行探究。
Ⅰ.下图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略)。
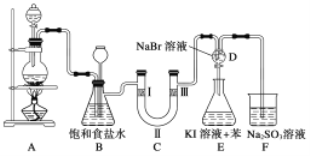
(1)制备氯气选用的药品为二氧化锰和浓盐酸,A中反应的化学方程式为
__________________________________。
(2)装置B中饱和食盐水的作用是______;同时装置B还能监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处最好依次放入________(填序号)。
①干燥的有色布条 ②湿润的有色布条 ③碱石灰④无水氯化钙 ⑤浓硫酸
(4)当向D中缓缓通入一定量氯气时,D中溶液逐渐变为______色;再打开D装置活塞,将装置D中少量溶液滴入锥形瓶E中,振荡,观察到的现象是___________________。
(5)有人提出,装置F中可改用足量的饱和NaHSO3溶液吸收氯气,请判断是否可行________(填“是”或“否”),理由是__________________________________ (用离子反应方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
![]()
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有误的是(填编号)____,若测定结果偏高,其原因可能是______.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是____________________________。
(3)如下图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com