
科目: 来源: 题型:
【题目】在下右图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b不满足题目要求的是
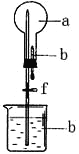
选项 | a(干燥气体) | b(液体) |
A | Cl2 | 饱和NaOH溶液 |
B | SO2 | 4mol/LNaOH溶液 |
C | NO2 | 水 |
D | NH3 | 1mol/L盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
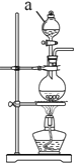
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(1)按如图所示的装置连接完仪器,在加药品之前应该做的操作是______________
(2)装置A中液体试剂选用_____________________________,
(3)装置B的作用是___________________________________,装置C的作用是____________________________________,装置E中碱石灰的作用是____________________________________________,
(4)装置D中发生反应的化学方程式是______________________________________
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式____。
(2)实验室常用MnO2与浓盐酸反应制备Cl2,装置如图所示:
仪器a的名称为____。制备实验开始时,先检査装置气密性,接下来的操作依次是____(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图所示装置:
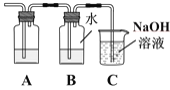
①装置A中应加入的试剂是____。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是____,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是____。
A.AgNO3溶液 B.石蕊试液 C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是____。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法____。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于含氯消毒剂的解释不正确的是
A. 室温下,氯气通入NaOH溶液中制得漂白液 Cl2+2OH-=Cl-+ClO-+H2O
B. 氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO
C. 氯水应避光保存的原因是:2HClO![]() H2O+Cl2↑
H2O+Cl2↑
D. 向Ca(ClO)2溶被中通入造量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
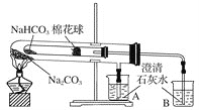
(1)点燃酒精灯加热,能观察到的实验现象是:棉花团变_____色,_____(填A或B)中的石灰水变浑浊
(2)由上述实验你能得出的结论是:Na2CO3的热稳定性_______(填大于或小于) NaHCO3
(3)写出碳酸氢钠受热分解的化学方程式______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
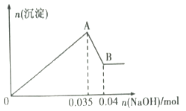
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________(填离子符号);
(2)A点沉淀的化学式___________________;
(3)写出A→B过程中发生反应的离子方程式:____________________________;
(4)该废水中,c(Al3+)=________;
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生在实验室做了5个实验:请选择符合实际情况的图象:

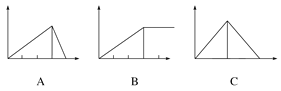
(1)向AlCl3溶液中逐滴加入稀氨水直至过量,沉淀的质量随氨水加入量的变化情况________
(2)向AlCl3溶液中逐滴加入NaOH溶液直至过量,沉淀的质量随NaOH溶液加入量的变化情况________
(3)向澄清石灰水中通入CO2直至过量,沉淀质量随CO2通入量的变化情况_____
(4)向Al2(SO4)3和MgSO4的混合溶液中加入NaOH溶液直至过量,沉淀质量随NaOH溶液加入量的变化情况________
(5)向NaOH溶液中逐滴加入AlCl3溶液至过量,沉淀质量随AlCl3加入量的变化情况_________
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的铜粉投入FeCl3溶液中,两者恰好完全反应,完成下列问题.
(1)写出该反应的离子方程式_______________________________
(2)该反应中的氧化剂是_______,氧化产物和还原产物的物质的量之比为________
(3)若反应过程中转移了0.2mol电子,则溶解消耗的铜的质量为 ________
(4)如何检验反应后的溶液中是否含有Fe3+________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
查看答案和解析>>
科目: 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 用盐酸酸化后,滴入AgNO3溶液产生白色沉淀,说明氯水中有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com