
科目: 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a.火烧孔雀石炼铜;b.湿法炼铜;现代有:c.铝热法炼铁;d.光卤石法炼镁。对它们的冶炼方法分析不正确的是
A. a用② B. b用③ C. c用④ D. d用⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下列有关金属冶炼的说法正确的是

A. 肯定发生的是置换反应
B. 肯定发生的是氧化还原反应
C. 只能用金属作还原剂冶炼金属
D. 如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于金属在地壳中的含量多少
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述错误的是
A. 5.6g Fe溶于过量硝酸,电子转移数目为0.3NA
B. 标准状况下,11.2L的SO3与足量水充分反应生成的溶液中H+的总数为NA
C. 由Na2O2和Na2O组成的混合物共l mol,其中阴离子数为NA
D. 3molNO2气体溶于足量水中充分反应转移的电子总数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A. X试剂可用Na2SO3饱和溶液
B. 步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C. 工业上每获得1molBr2,需要消耗Cl244.8L
D. 步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
A. 在饱和AgCl、AgBr的混合溶液中:![]() =360
=360
B. 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C. AgCl在水中溶解度及Ksp均比在NaCl溶液中的大
D. 欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用空气吹出法提取溴的部分流程如下:

下列说法错误的是()
A. ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O =5Br-+BrO3-+6HCO3-
B. 第③步,需加入氧化性酸,才能将Br-氧化为Br2
C. B溶液颜色要比A溶液深
D. 第④步,采用的是蒸馏的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案、现象、得出的结论均正确的是
选项 | 实验及现象 | 结论 |
A | 向SiO2固体加入过量盐酸振荡,固体不溶解 | SiO2不溶于任何酸 |
B | 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 | 该样品含钠元素 |
C | 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 白色沉淀为BaSO3 |
D | 将镁条点燃,迅速伸入集满CO2的集气瓶有白色固体和黑色颗粒产生 | CO2具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
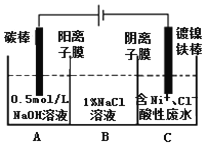
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
操 作 | 现 象 |
取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH | pH试纸变红(约为4) |
| ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
试管 | 操作 | 现象 | 结论 |
a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
| Cl2的氧化性强于Fe3+ |
b | 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 |
|
c | | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com