
科目: 来源: 题型:
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。
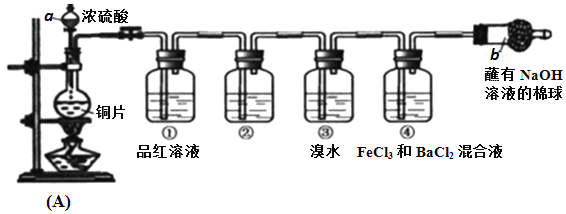
请回答:
(1)写出A反应装置中的化学方程式:____________
(2)棉球中NaOH溶液的作用是________________
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_________。
A.澄清石灰水 B.无色酚酞试液 C.碘水 D.紫色石蕊试液
(4)下列说法正确的是____________。
A.先向装置中加入试剂(药品),再进行气密性检查
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)写出洗气瓶③中反应的化学方程式:_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提纯Al2O3做冶炼铝的原料,提取的操作过程可用以下流程图表示:
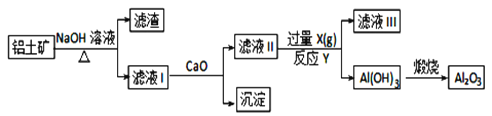
已知:Na2SiO3 + Ca(OH)2= CaSiO3↓+ 2NaOH
(1)氢氧化钠溶液浸取铝土矿时,发生反应的离子方程式有:______________________、______________________。
(2)滤液II中通入过量的气体X是________。反应的化学方程式:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_______________________________________________________。
(2)B为0.1 mol·L-1Na2CO3溶液,该溶液显碱性的原因为:______________。(写离子方程式)
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________以抑制其水解。把B和C溶液混合,发生反应的离子方程式为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)表中b_____c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为_____mol/L,0~20s内N2O4的平均反应速率为_________.
(3)该反应在80℃时该反应的平衡常数K值为_______(保留2位小数).
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下:
____ FeS2+ ____ H++ ____ NO3-= ____ Fe2++ ____ S↓+ ____ NO↑+ ____H2O
回答下列问题:配平此氧化还原反应方程式_____________________________________,还原剂为______________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是_____(填字母)
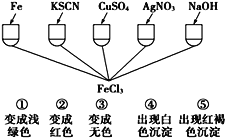
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①该反应在常温下_______(填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是____(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=________(取小数点后两位,下同)。
②该反应的正反应为________(
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等。
(1) 某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
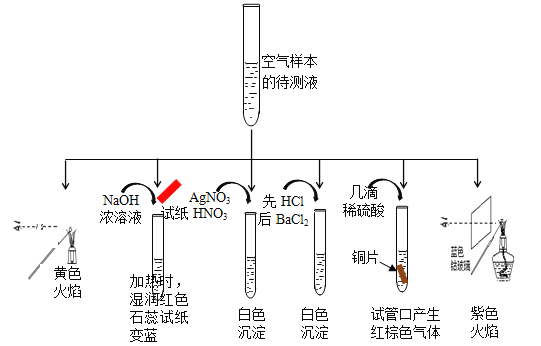
①该实验能确认存在的阳离子是 。
②该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确的是 (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
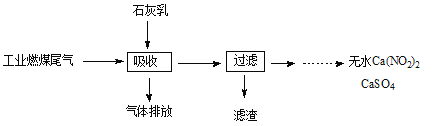
①CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
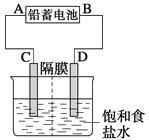
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO![]() -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_______________________________________。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量)时,
①若收集到11.2 L(标准状况下)氯气,溶液pH=_________________。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为___________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列计算结果正确是
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2=3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的1/8
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为(1/22.4)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com