
科目: 来源: 题型:
【题目】在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)![]() Ca(OH)2(aq)
Ca(OH)2(aq)![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
A. n (Ca2+)增大 B. c(Ca2+)不变
C. c(OH-)增大 D. n(OH-)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 在透明溶液中:Cu2+、Mg2+、SO42-、Cl-
B. 加入铝粉产生H2的溶液中:Ba2+、Fe2+、HCO3-、NO3-
C. NaAlO2溶液中:Cu2+、Al3+、Cl-、CO32-
D. 常温下AG=lg![]() =12的溶液中:Na+、K+、S2O32-、SO42-
=12的溶液中:Na+、K+、S2O32-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 在标准状况下,11.2L O2和22.4L NO混合并充分反应后得到的气体的分子数为NA
B. 常温下0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA
C. 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
D. 25℃时,1.0L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质:①C60、C70、金刚石、石墨; ②苯甲醇、对甲基苯酚、邻甲基苯酚、间甲基苯酚;③![]() C、
C、![]() C、
C、![]() C;④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO;⑤新戊烷、2,2-二甲基丙烷; ⑥甲醇、乙二醇、丙三醇。
C;④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO;⑤新戊烷、2,2-二甲基丙烷; ⑥甲醇、乙二醇、丙三醇。
从左至右按同类有机物、同位素、同系物、同分异构体、同素异形体、同种物质的顺序排列正确的是( )
A. ①⑥②③⑤④ B. ⑥③⑤④①②
C. ④②⑥①⑤③ D. ⑥③④②①⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH4+):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的___________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成CuI白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I-)。
+2I-)。
①可选用________________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为_______________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目: 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:

(1) ClO2中所有原子_____________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用_________
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2) 稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是_________
A.二氧化氯可广泛用于工业和饮用水处理
B.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
C.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为______________________。
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 __________________,此法相比欧洲方法的优点是______________________。
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_____________________________。此法提高了生产及储存、运输的安全性,原因是 _________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
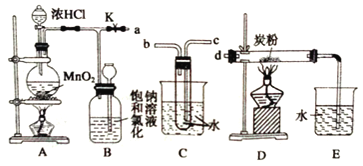
(1)A中圆底烧瓶内发生反应的离子方程式:_____________________________________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是___________________________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com