
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
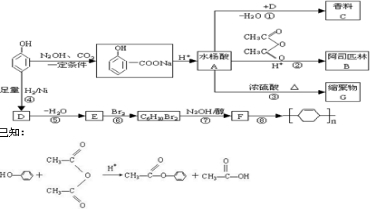
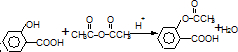
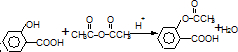
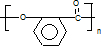

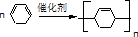

查看答案和解析>>
科目: 来源: 题型:
下列各组离子在水溶液中能大量共存的是( )
①I—、NH4+、NO3—、H+②Fe2+、H+、K+、ClO—;③Fe3+、Fe2+、Cu2+、SO42—;④AlO2—、K+、HSO3—、HCO3—
⑤SO32—、SO42—、Cl—、OH—;
⑥Ca2+、Na+、SO42—、CO32—
A.①和⑥ B.③和⑤
C.③、④和⑤ D.②和④
查看答案和解析>>
科目: 来源: 题型:
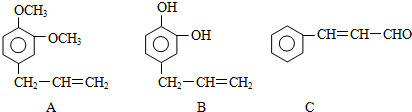
 +5H2
+5H2| 一定条件 |

 +5H2
+5H2| 一定条件 |

| [O] |


 +n
+n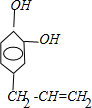
| 一定条件 |
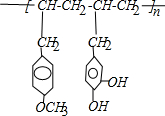
 +n
+n
| 一定条件 |

查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||
| ||
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
查看答案和解析>>
科目: 来源: 题型:
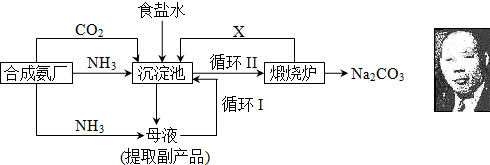
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com