
科目: 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀):
![]()
![]()
![]() ,②
,②![]()
![]()
![]()
![]()
![]() →CuSO4·5H2O晶体
→CuSO4·5H2O晶体
下列分析中正确的是
A. 用98%的浓硫酸配制溶解所用的4.5 mol·L-1的稀硫酸,只需3种玻璃仪器
B. 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量氯气
C. 利用Cu(OH)2替代CuO也可调节溶液pH而不影响实验结果
D. 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
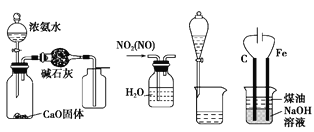
图1 图2 图3 图4
A. 用图1所示装置制取并收集干燥纯净的NH3
B. 用图2所示装置可除去NO2中的NO
C. 用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D. 用图4所示装置制取Fe(OH)2,并较长时间观察其存在
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是
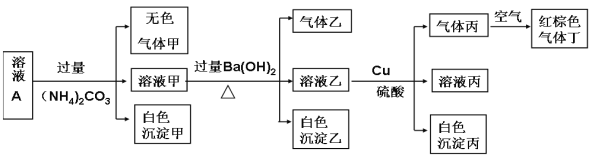
A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
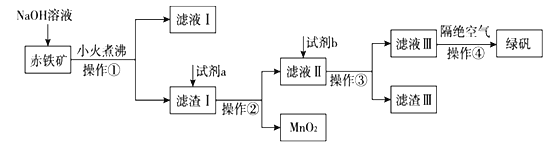
(4)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________________________。
(5)向滤渣Ⅰ中加入过量的试剂a为___________,加入过量试剂b后所得滤渣Ⅲ的主要成分为______。
(6)操作③需要的玻璃仪器主要包括_______________。
(7)操作④需要隔绝空气的主要原因可能是什么?______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为 0.1molL﹣1.某同学进行了如下实验:

下列说法正确的是( )
A. 无法确定原试液中是否含有 Al3+、 Cl﹣
B. 滤液 X 中大量存在的阳离子有 NH4+、 Fe2+和 Ba2+
C. 无法确定沉淀 C 的成分
D. 原溶液中存在的离子为 NH4+、 Fe2+、 Cl﹣、 SO42﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) ![]() 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡的是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
NO | N2 | CO2 | |
起始浓度/molL─1 | 0.10 | 0 | 0 |
平衡浓度/molL─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
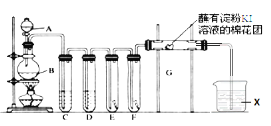
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式__________________________。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是________________________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(3)试管C和D中试剂各为_____________________________。
(4)装置G处发生反应的离子方程式为_______________________________。
(5)用离子方程式表示试剂X的作用_________________________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________________。
②需“密闭保存”的原因____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42-
B. c(H+)/c (OH-)=10-10的无色溶液:Na +、Ba2+、NO3-、Cl-
C. 由水电离产生c(H+)=10-10mol·L-1的溶液:![]() 、AlO2-、Ca2+、S2-
、AlO2-、Ca2+、S2-
D. c(ClO-)=1.0 mol·L-1的溶液:K+、SO32-、S2-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】为了将混有Na2SO4、NH4HCO3的NaCl提纯。某学习小组设计了如图所示的方案:
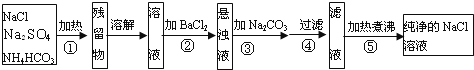
(1)操作①盛放药品的仪器名称是___________,发生反应的化学反应方程式为__________________。
(2)进行操作②后,如何判断杂质是否除尽?_______________________________________________。
(3)操作③的目的是_____________________。
(4)请你评价该设计方案设计是否严密?若不严密,请说明理由,并提出改进方案_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A. 能使广范pH试纸显红色的溶液:K+、Ba2+、Cl-、Br-
B. 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42-
C. 能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、SO32-
、S2-、SO32-
D. 常温下![]() =1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com