
科目: 来源: 题型:
【题目】现有下列十种物质:①0.1mol/L硫酸②小苏打③纯碱④二氧化碳⑤葡萄糖⑥0.1mol/LNaOH溶液⑦SiO2 ⑧氨水⑨Al2O3⑩硫酸铁溶液
(1)上述十种物质中属于非电解质的有_____(填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是______(填序号)。
(3)既能跟盐酸反应又能跟NaOH溶液反应的是_____(填序号)。
(4)标准状况下,_____L④中含有0.4mol氧原子。
(5)⑥与⑦溶液反应的离子方程式为__________。
(6)硅是信息技术的关键材料,写出工业上用⑦制备粗硅的化学反应方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:

①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
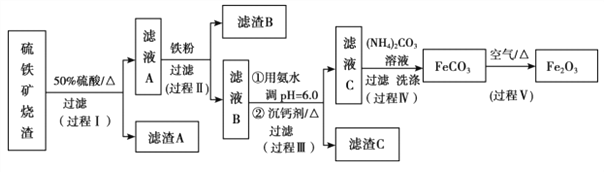
已知:生成氢氧化物的 pH 如下表所示
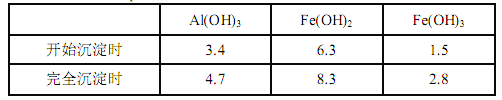
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
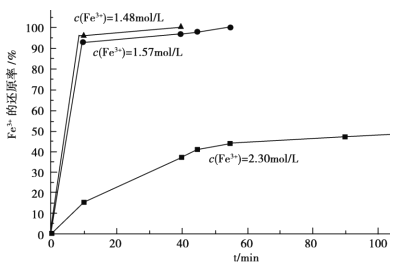
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
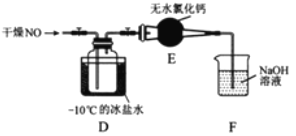
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某些烃的分子结构模型如图所示。

回答下列问题:
(1) 属于比例模型的是_______(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是_______;
(3)存在同分异构体的是_______;写出其同分异构体的结构简式___________;
(4) C10H14属于苯的同系物的所有同分异构体共有_______种。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是____________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
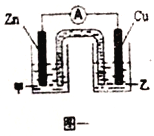
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是_______(填“ZnSO4”或“CuSO4”)溶液;Cu极的电板反应式是_______。
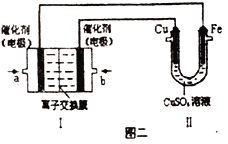
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处通入的是_______(填“CH4”或“O2”),a处电极上发生的电极反应式是_____________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为_____________________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V (已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
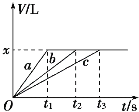
A. x=2.24 B. 曲线b为Mg与盐酸反应的图象
C. 反应时,Na、Mg、Al均过量 D. 钠的物质的量为0.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com