
科目: 来源: 题型:
【题目】标准状况下一定体积的HCl气体,将其溶于500mL的稀硫酸溶液中,假设溶液的体积不变化,向混合溶液中加入0.60mol/L的NaOH溶液50mL恰好呈中性。继续向呈中性的溶液中加入过量的氯化钡溶液,所的沉淀的质量为2.33g。
(1)生成沉淀的离子反应方程式:_______________________________。
(2)原硫酸溶液的浓度为:______________________________________。
(3)标准状况下HCl气体的体积为多少毫升?(写出计算过程)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据有关知识回答下列问题。
(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
(1)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH 1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式___________________________。
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式_____________________________________。
(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。

(3)A是石墨棒,B是一种金属,该金属是________(填名称)。
(4)B应接电源的________极(填“通入CO”或“通入O2”)。
(5)写出该装置中发生还原反应的电极反应式___________________________________。
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式_________________,当放出标况下112mL氢气时,该溶液的pH=_____________(室温下)。
(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。

(7)若X为铜,为减缓铁的腐蚀,开关K应置于______处。
(8)若X为锌棒,开关K置于M处,该电化学防护法称为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
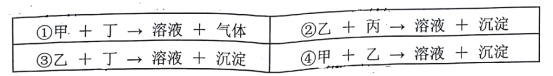
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组同学用含有少量泥沙、CaCl2、MgCl2、Na2SO4的粗盐制取纯净的NaCl,实验前他们设计了如图方案(框图)
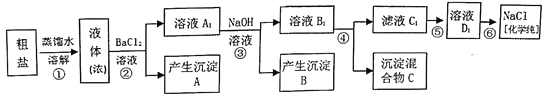
(1)请写出操作第④步所加试剂名称及第②步操作名称:
④_____________________,②___________________________。
(2)写出第⑤步操作中可能发生反应的离子方程式:____________________。
(3)如何检验第②步操作中硫酸根离子已完全除尽:_____________________。
(4)你认为该设计里哪些步骤调换后不影响实验结果:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中数据是常温下HClO和H2CO3的电离常数,回答有关问题。

(1)下列能正确表示水解的离子方程式的是______________。
A.HCO3- + H2O![]() H2CO3+OH- B.HClO + H2O
H2CO3+OH- B.HClO + H2O![]() ClO-+ H3O+
ClO-+ H3O+
C.HCO3- + H2O![]() CO32--+H3O+ D.CO32-+2H2O
CO32--+H3O+ D.CO32-+2H2O ![]() H2CO3+2OH-
H2CO3+2OH-
(2)浓度相同的①Na2CO3;②NaHCO3;③NaClO三种溶液的pH由小到大排列的顺序为(用编号填写)________________________。
(3)写出NaClO溶液中通入少量CO2气体的离子方程式________________________。
(4)在新制氯水中加入少量碳酸氢钠粉末后,氯水的漂白能力增强,请用有关化学知识解释原因_____________________________________________。
(5)在等浓度的NaClO、NaHCO3混合溶液中,阴离子浓度的大小关系是__________。
(6)在pH=8的NaClO和HClO混合液中,c(ClO-)/c(HClO)=____________________。
(7)已知HClO(aq)与NaOH(aq)反应的ΔH =-a kJ/mol;HCl(aq)溶液与NaOH(aq)反应的ΔH =-b kJ/mol。则HClO在水溶液中电离的ΔH等于____________。
(8)pH=12的NaClO溶液中,c(HClO)=___________mol/L。(精确表达)
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲配制3.0mol/L的H2SO4溶液100mL,实验室有标准浓度为90%、密度为1.80g/mL的硫酸溶液。请回答下列问题:
(1)实验所用90%的硫酸的物质的量浓度为________mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为_______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤A、C补充完整。
A.用量简准确量取所需的90%的硫酸溶液_______mL,沿玻璃棒倒入少量蒸馏水中,并用玻璃棒搅拌,使其混合均匀;
B.将混合均匀的硫酸溶液沿玻璃棒注入所选的容量瓶中;
C.______________________________________________;
D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
E.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
F.将容量瓶盖紧,振荡,据匀。
(4)如果省略操作C,对所配溶液浓度有何影响?______(填“偏大”、“偏小”或无影响”)
(5)进行操作B前还需注意__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列物质:①氯气,②澄清石灰水,③水银,④稀盐酸,⑤氯化铜固体,⑥熔融氢氧化钠,⑦蔗糖,⑧酒精,⑨二氧化碳,⑩硫酸钡。其中属于电解质的是______(填序号,下面相同),属于非电解质的是_________,能导电的是_________。
(2)写出高锰酸钾受热分解制氧气的化学反应方程式____________________,反应中的氧化剂是________,还原产物是____________,当有2mol电子转移时,生成的氧气在标准状况下的体积是________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量浓度相等的NaCl、FeCl2、FeCl3三种溶液分别与等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、FeCl2 、FeCl3三种溶液的体积之比是
A. 1:2:3 B. 3:2:1 C. 6::3:2 D. 1:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学做中和滴定和中和热的测定两个实验。
Ⅰ.下图是该小组同学用0.5000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和第1次滴定前、后盛放盐酸的滴定管中液面的位置。请回答下列问题。

(1)仪器A的名称是_______________。
(2)第1次滴定消耗标准液_________mL 。
(3)已知每次滴定操作所取待测NaOH溶液的体积均为20.00mL。第2、3、4次滴定数据如下表所示。通过计算得待测NaOH溶液的平均浓度是___________mol/L。(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
2 | 20.00 | 1.20 | 21.20 |
3 | 20.00 | 2.24 | 22.26 |
4 | 20.00 | 1.50 | 21.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.向锥形瓶里注入20.00 mL待测NaOH溶液,并滴入2-3滴酚酞;
B.用标准溶液润洗酸式滴定管2-3次;
C.固定好装标准溶液的酸式滴定管,调节滴定管尖嘴使之充满溶液,管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2-3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准HCl溶液滴定至终点并记下滴定管液面刻度。
合理的操作顺序是(用序号字母填写)______________________________。
(5)如何判断到达滴定终点?_________________________________________。
(6)如果上述B步骤省略,对测定结果的影响是_________;标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是______(填“无影响”、“偏高”、“偏低”)。
Ⅱ.现用上述盐酸和已测出浓度的NaOH溶液,设计如下装置测定中和热。
将50mL盐酸与50mL NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(7)从图示看此装置存在错误,请指出_________________。
(8)当室内温度低于10℃时,对实验数据影响很大,实验测得的中和热数值偏小。其原因是___________________。
(9)如果实验测得起始温度为t1℃,反应后的最高温度为t2℃,则中和热的表达式为ΔH =___________。(中和后溶液的比热容c=4.18J/(g.℃))
(10)本次实验室内温度正常,操作无误,但是数据偏低,其原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识填写下列空白。
(1)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成1mol NH3的反应热ΔH =__________________。
(2)氢气的燃烧热为286kJ/mol。写出表示氢气燃烧热的热化学方程式____________________________________________。
(3)某温度下纯水中的c(H+) = 1×10-6.5mol/L。若温度不变,滴入稀硫酸使c(H+)= 5×10-5mol/L,则由水电离出的c(H+) =__________mol/L。
(4)已知在第(3)问条件下,盐酸的pH=a,氢氧化钡的pH=b。若酸碱按体积比1:10混合后溶液显中性,则a+b=_________。
(5)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-, HB- ![]() H++B2-。
H++B2-。
已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中c(H+)小于0.11 mol/L的原因是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com