
科目: 来源: 题型:
【题目】用MnO2 和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则计算:
(1)制Cl2的反应中转移电子的数目?
(2)生成Cl2的体积(标准状况下)?
(3)制得漂白粉[CaCl2和Ca( ClO)2的混合物]的质量? (写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。
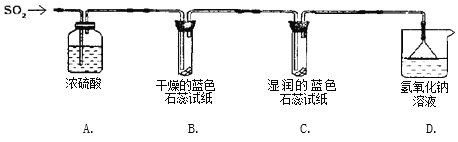
(1)A装置的作用是______________。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成_____色,说明SO2与水反应生成一种酸。
(3)D装置的作用是_________ ,写出反应的化学方程式_____________________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终成_______。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_____。
(探究结论)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(1)酸雨造成的危害是:______________________________。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
(提出建议)该市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人_________(填“水”或“乙醇”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为 ( )
A.![]() (a+b) mol B.(a-b) mol C.
(a+b) mol B.(a-b) mol C.![]() (a-b)mol D.(a+b) mol
(a-b)mol D.(a+b) mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是 ( )
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的[FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为__________,N-N键的键角为__________。
(2)基态砷原子的价电子排布图为__________,砷与同周期相邻元素的第一电离能由大到小的顺序为__________。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是__________(填"PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是__________。S-Cl键键长__________P-Cl键键长__________(填“>”、“=”或“<”),原因是__________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为__________。若该晶体的密度为ρgcm-3,设NA为阿伏加德罗常数的值,则a、b的距离为__________pm(用含ρ和NA的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象与对应化学方程式都正确的是( )
A. 钠投入水中,浮在水面熔成小球,在水面快速移动,得到的溶液显碱性;2 Na + 2 H2O ![]() 2 NaOH + H2↑
2 NaOH + H2↑
B. 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2 + Cl2 ![]() 2HCl
2HCl
C. FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2 + O2 + H2O ![]() 2 Fe(OH)3
2 Fe(OH)3
D. 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有硅酸胶体产生;Na2SiO3 + 2HCl ![]() H2SiO3+ 2NaCl
H2SiO3+ 2NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上CO2用于生产燃料甲醇,既能缓解温室效应,也为能源寻找了新渠道。合成甲醇的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。
(1)已知:CO的燃烧热△H=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1KJ/mol
CH3OH(g) △H=-90.1KJ/mol
则:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=___KJ/mol
CH3OH(g)+H2O(g) △H=___KJ/mol
(2)T℃时,测得不同时刻恒容密闭容器中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度变化如下表所示
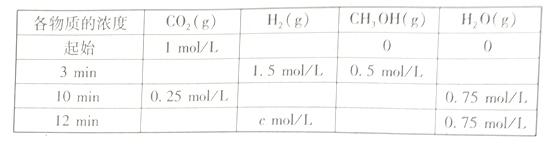
①c=___mol/L,从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=__
②下列能说明该反应达到平衡状态的是____________
A.每消耗 1mol CO2的同时生成1 mol CH3OH
B.容器中气体的压强不再改变
C.混合气体的平均相对分子质量不发生变化
D.容器中气体的密度不再改变
(3)在催化剂作用下,若测得甲醇的产率与反应温度、压强的关系如下图所示:
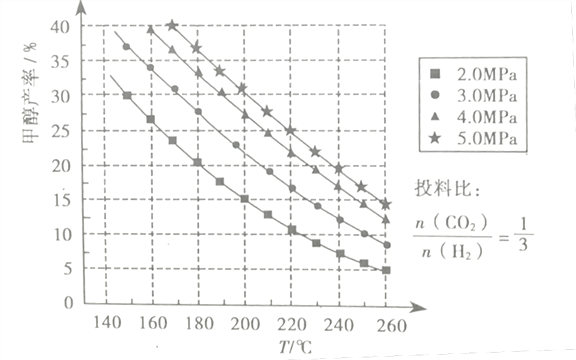
①分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为__将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将___(填“增大”、“减小”或“不变”)
②200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量为___g(用含a的代数式表示)
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6x10-8,Ksp(PbCO3)=7.4×10-14,
PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B. 78g Na2O2与足量水充分反应时电子转移数为2NA
C. 标准状况下,22.4L SO3中所含的SO3分子数为NA
D. 常温常压下,8g O2所含的质子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com