
科目: 来源: 题型:
【题目】某学习小组为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。
①完成本实验需要不断用玻璃棒搅拌,其目的是_______________________________。
②若实验前所称样品的质量为m g,加热至恒重时固体质量为a g,则样品中纯碱的质量分数为________。
(2)方案二:按如图所示装置进行实验,并回答下列问题:
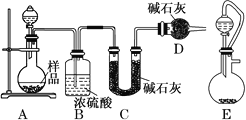
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀硫酸装入分液漏斗中。D装置的作用是________________。
②实验中除称量样品质量外,还需分别称量_______装置反应前、后质量(填装置字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显的缺陷,该缺陷是_________。
④有同学认为,用E装置替代A装置能提高实验准确度。你认为是否正确?_________(填“是”或“否”)。
(3)方案三:称取一定量的样品置于锥形瓶中,加适量水,用盐酸进行滴定,从开始至有气体产生到气体不再产生,所滴加的盐酸体积如图所示,则小苏打样品中纯碱的质量分数为_________(保留两位有效数字)。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
B. KClO3+6HCl=KCl+3Cl2↑+2H2O,氧化剂和还原剂物质的量之比为1:5
C. 2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1:1
D. 3S+6KOH=2K2S+K2SO3+3H2O中被氧化和被还原的硫元素物质的量之比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 由反应SiO2+2C ![]() Si+2CO↑,可得出C的非金属性强于Si
Si+2CO↑,可得出C的非金属性强于Si
B. 由分子组成的物质中一定存在共价键
C. 对于平衡2HI(g)![]() I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
D. 水的电离是吸热过程,升高温度,水的离子积增大、pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
(背景素材)
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3—,MnO4—被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I氧化为I2,S2O32—能将I2还原为I。
(制备氮氧化物)
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为______,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
(制备Ca(NO2)2)
(2)乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
(测定Ca(NO2)2的纯度)
(3)丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1mol·L1的KI溶液 c.淀粉溶液 d.c2 mol·L1的Na2S2O3溶液 e.c3mol·L1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是__________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,_______(请补充完整实验步骤)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某化学兴趣小组设计的利用电子垃圾(含70% Cu、25% Al、4% Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:

已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
开始沉淀 | 1.1 | 4.0 | 5.4 |
完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:_________________________________。
(2)在操作Ⅱ中,x的取值范围是____________。
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有________________。
(4)由滤渣a制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣a―→H2SO4―→操作Ⅲ―→Al2(SO4)3·18H2O
乙:滤渣a―→H2SO4―→适量Al粉,过滤―→操作Ⅲ―→Al2(SO4)3·18H2O
丙:滤渣a―→NaOH溶液,过滤―→H2SO4―→操作Ⅲ―→Al2(SO4)3·18H2O
综合考虑上述三种方案,最具可行性的是______(填序号)。
(5)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用b mol·L-1 EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-===CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00 mL(常温时,5%的Na2H2Y水溶液,其pH为4~6),则CuSO4·5H2O晶体的纯度是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图所示。下列对t1时刻改变条件的推断正确的是( )
2SO3(g) ΔH<0。达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图所示。下列对t1时刻改变条件的推断正确的是( )
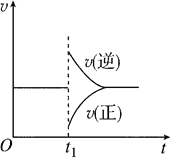
A. 保持压强不变,升高反应温度
B. 保持温度不变,增大容器体积
C. 保持温度和容器体积不变,充入1 mol SO3(g)
D. 保持温度和压强不变,充入1 mol SO3(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计能够成功的是
A. 检验亚硫酸钠试样是否变质:![]()
B. 除去乙酸乙酯中混有的乙酸:![]()
C. 证明酸性条件下H2O2氧化性比I2强:![]()
D. 鉴定盐A的成分是FeBr3:![]()
查看答案和解析>>
科目: 来源: 题型:
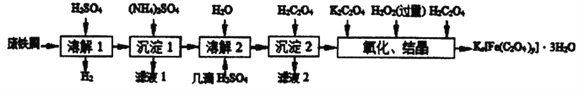
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
![]()
A. C12+2OH-=Cl-+ClO-+2H2O
B. Cu2++2OH-=Cu(OH)2↓
C. SO42-+Ba2+=BaSO4↓
D. OH-+HCO3-=H2O+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com