
科目: 来源: 题型:
【题目】下列反应产生氢气的物质的量最多的是
A. 足量的Mg与0.5mol·L-1的稀硝酸200mL
B. 足量的Cu与5mol·L-1的硫酸400mL
C. 足量的Al与0.3mol·L-1的氢氧化钠溶液200mL
D. 足量的Mg与0.5mol·L-1的稀盐酸200mL
查看答案和解析>>
科目: 来源: 题型:
【题目】中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质。

(1)检验该套装置气密性的方法是:______________________________;
(2)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶。反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:_________________________________________;
(3)该方法制取氯气比用纯净的高锰酸钾要缓和平稳许多,试分析原因:________;
(4)该小组利用装置C吸收氯气制备漂白粉。
①C中盛装的试剂为:________________________________;(写名称)
②陶瓷多孔球泡的作用是:_________________________________________________;
(5)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/L KI溶液进行滴定,三次平行实验平均每次消耗20.00mL标准液时达到滴定终点。已知氧化性:ClO-> IO3-> I2
①所选的指示剂为:______________,到达滴定终点的标志是:______________________;
②该漂白粉中有效成分的质量分数为:__________________________。
(6)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为:______________;该现象能够证明氯气有氧化性。
查看答案和解析>>
科目: 来源: 题型:
【题目】纯二氧化硅可用下列流程制得.下列说法不正确的是
![]()
A. X可用作木材防火剂
B. 步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3(胶体)+ Na2SO4
C. 步骤Ⅱ中的稀硫酸可用CO2来代替
D. SiO2既能与盐酸反应,又能与氢氟酸反应,所以SiO2是两性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下: NaClO+ NH3H2O—— N2H4+ NaCl+ H2O
(1)请配平上述化学方程式,并用单线桥法标出电子转移的方向和数目。__________
(2)NH3H2O在上述反应中显示出来的性质是__________。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)当转移10mol电子时,被氧化的物质的质量为__________。
(4)NH3H2O的电离方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示常温下,将SO2气体通入溴水中,所得溶液pH的变化
B. 图2表示向NH4A1(SO4)2溶液中逐滴滴入NaOH溶液,沉淀总物质的量(n)随NaOH溶液体积(V)的变化
C. 图3表示T °C时,对于可逆反应:A(g)+B(g)![]() 2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系
2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系
D. 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH = 7的溶液中,Fe3+、A13+、Fe2+能大量共存
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下,下列说法不正确的是

A. X 中肯定存在 Fe2+、A13+、NH4+、SO42-
B. X中不能确定是否存在的离子是Al3+和Cl-
C. 溶液E和气体F发生反应,生成物为盐类
D. 气体A是NO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】为检验某加碘食盐中是否含有KIO3,取相同食盐样品进行下表所示实验:
(已知:KIO3 + 5KI + 3H2SO4![]() 3I2 + 3K2SO4 + 3H2O)
3I2 + 3K2SO4 + 3H2O)
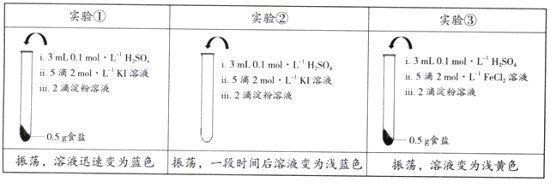
下列说法中正确的是
A. 仅由实验①就能证明食盐样品中存在KIO3
B. 实验②中发生反应的离子方程式为4I-+ O2 + 4H+ ![]() 2I2 + 2H2O
2I2 + 2H2O
C. 实验③能证明食盐样品中不存在KIO3
D. 以上实验说明离子的还原性:I- > Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com