
科目: 来源: 题型:
【题目】实验室利用下列装置制氯气,请填空:
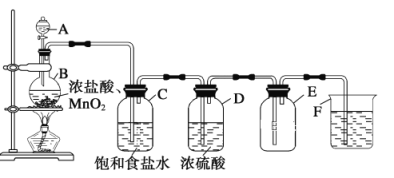
①制氯气的反应原理,请用化学方程式表示:______________。
②饱和食盐水的作用是_________________________________________________。
③浓硫酸的作用是_________________________________________________。
④氢氧化钠的作用是_________________________________________________。
⑤向上排空气法收集氯气的理由是_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室检验化合物E的反应。

(1)单质L是________;化合物A是________。
(2)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是:______________________和_____________________。
(3)E和K、J混合溶液反应的化学方程式为____________________。此反应的发生说明了_____________________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NaHCO3的知识填空。
(1)NaHCO3俗名_________。
(2)NaHCO3水溶液中滴入酚酞后,溶液呈_________色。
(3)NaHCO3与盐酸反应的离子方程式__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验。能证明水合草酸亚铁中存在Fe2+的试剂有____(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(2) 为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
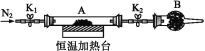
实验步骤如下:
a.打开K1和K2,缓缓通入N2; b.低温加热装置A一段时间;
c.停上加热,冷却到室温; d.关闭K1和K2,称量A;
e. ,记为m3 g。
①补充实验步骤e为__________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是___________________。
(3)为探究草酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
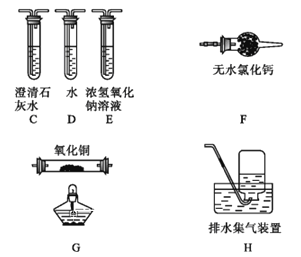
①实验装置中,依次连接的合理顺序为A→_______________。
②证明产物有CO生成的现象是________________。
③写出草酸亚铁受热分解的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.5molCH4的质量是_______________g,在标准状况下的体积为_______________L;含有约______________个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为_____
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO![]() 、OH- B. Na+、Ca2+、CO
、OH- B. Na+、Ca2+、CO![]() 、NO
、NO![]()
C. Na+、H+、Cl-、CO![]() D. Na+、Cu2+、Cl-、SO
D. Na+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示:
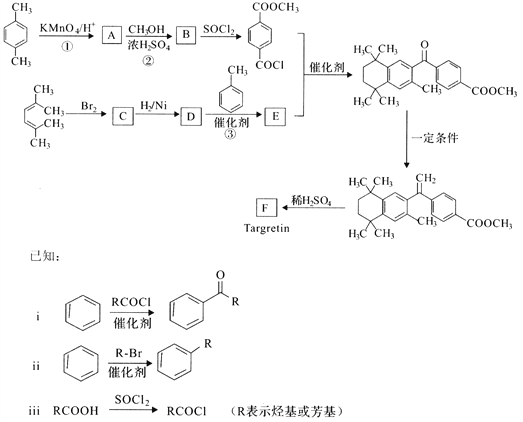
(1)反应①的反应类型是______________。
(2)反应②的化学方程式:__________________________________________。
(3)C的核磁共振氢谱图中有______________个峰。
(4)反应③的化学方程式:__________________________________________。
(5)F的分子式是C24H28O2. F中含有的官能团:__________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或![]() 结构):_______________________________________________________________。
结构):_______________________________________________________________。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知:![]() 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
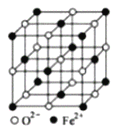
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2![]() 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
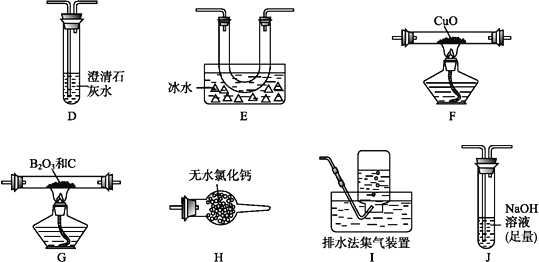
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→__→__→__→__→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“A” 或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤硼酸是一元弱酸,其钠盐化学式为Na [B(OH)4],则硼酸在水中电离方程式是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为_________________。
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为_______________。
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1)可循环使用的物质是______。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为__________________。
(2) 检验CaO2·8H2O是否洗净的操作是________。
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com