
科目: 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】用情性电极电解一定浓度的CuSO4溶液,通电—段时间后,向所得的溶液中加入9.8g Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是
A. 电解过程中阴极没有气体生成
B. 电解过程中阳极收集到的气体体枳为1.12L(标况下)
C. 原CuSO4溶液的浓度为0.1 mol·L-1
D. 电解过程中转移的电子的物质的量为0.4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42-=BaSO4↓
B. 铁与稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑
C. 氯气与水反应:Cl2 + H2O =2H+ +C1- + ClO-
D. 氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=Al(OH)3↓+ 3 NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 足量Fe与1molCl2完全反应,转移电子的数目为3NA
B. 22.4 L 氧气含有的分子数为NA
C. 常温常压下,28 g氮气所含的原子数为2NA
D. 0.1 mol/L的氯化铝溶液中,含有Cl的数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是

A. Cu电极上发生还原反应 B. 电子沿 Zn→a→b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大 D. 片刻后可观察到滤纸b点变红色
)增大 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )

A. 在阴极室,发生的电极反应为2H2O+2e-=2OH-+H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO+2H+![]() Cr2O+H2O向右移动
Cr2O+H2O向右移动
C. 该制备过程中总反应的化学方程式为4K2CrO4+4H2O=2K2Cr2O7+4KOH+2H2↑+O2↑
D. 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-d
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气设计了如下实验装置。

请按要求回答下列问题:
(1)仪器X的名称为_________________。
(2)已知装置B中选用的试剂为饱和食盐水,其作用为 __________________。
(3)将氯气通入C中的紫色石蕊试液,可以观察到的现象是________________________。
(4)装置E中装有NaOH溶液,该装置中反应的化学方程式 ________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各图的叙述错误的是 ( )


A. 已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B. 常温下0.2 mol·L-1 HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)> c(Na+)>c(H+)>c(OH-)
C. 常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱
D. 图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
查看答案和解析>>
科目: 来源: 题型:
【题目】镧系金属元素鈰(Ce)常见有+3、+4两种价态,鈰的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成![]() 物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
(2)用电解的方法可将上述吸收液中的![]() 转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
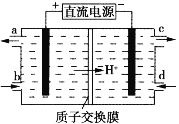
①无毒气体从电解槽的___________(填字母序号)口逸出。
②每生成标准状况下22.4 L无毒气体,同时可再生Ce4+_____________mol。
(3)鈰元素在自然界中主要以氟碳鈰矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳鈰矿提取CeCl3的一种工艺流程如下:
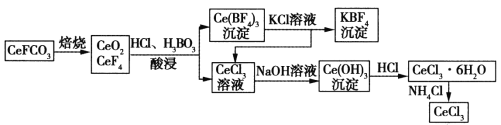
①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为______________。
②假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式________________________________________。
③向Ce(BF4)3中加入KCl溶液的目的是________________________________________。
④常温下,当溶液中的某离子浓度![]() 时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。
时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。![]()
⑤加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com