
科目: 来源: 题型:
【题目】某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液。实验操作过程如下:
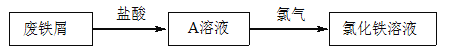
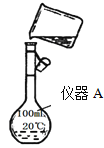
根据要求回答问题:
(1)用浓盐酸配制250mL 0.2molL-1稀盐酸,图中有两处错误分别是_____________,______________。
(2)废铁屑用盐酸处理后,还含有不溶性杂质,为获取澄清的A溶液,进行物质分离的操作名称是___________。
(3)若FeCl2溶液中混有少量的FeCl3溶液,现要加入一种试剂除去FeCl3,请写出除杂的离子方程式______________________。
(4)配制250mL 0.2molL-1稀盐酸时,下列操作会造成结果偏高的是(_______)
A.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
B.转移溶液前溶液未冷却至室温
C.未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶的刻度线
E.容量瓶洗涤干净后,瓶内壁有少量水滴。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温时,将浓度为m molL﹣1的CH3COOH溶液和n molL﹣1 NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m____ n(填“>”、“<”或“=”,下同);若将pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合,混合溶液的pH______ 7。
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应_________________.
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为_________.
(4)常温时Ksp[Cu(OH)2]=2.2×10﹣20,将Cu(OH)2溶于2.2mol/L CuCl2溶液中形成平衡溶液的pH为____.
(5)物质的量浓度相同的下列溶液①(NH4)2CO3②(NH4)2SO4③NH4HCO3④NH4HSO4⑤NH4Cl⑥NH3H2O,c(NH4+)由小到大的排列顺序是___________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应![]() Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)![]()
![]() Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
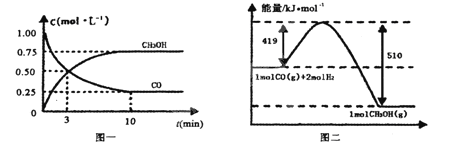
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 | CH3OH的浓度 | 能量变化 |
甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
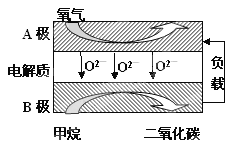
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计下列方案对A盐的水解液进行鉴定:![]() 由此得出的结论中,不正确的是
由此得出的结论中,不正确的是
A. D溶液中存在Fe(SCN)3 B. A一定为无氧酸盐FeBr2 C. B为AgBr D. 滤液中有Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为________ (阿伏加德罗常数用NA表示),放出的热量为________kJ。
(2)已知:C3H8(g) == CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g) == CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g) === CH3CH=CH2(g)+H2(g)的ΔH=______kJ·mol-1。
(3)甲烷在高温下与水蒸气反应的方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。部分物质的燃烧热数据如下表:已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式: _______________________________。
CO(g)+3H2(g)。部分物质的燃烧热数据如下表:已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式: _______________________________。
物质 | 燃烧热(kJ·mol-1) |
H2(g) | -285.8 |
CO(g) | -283.0 |
CH4(g) | -890.3 |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
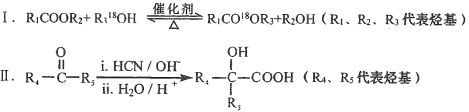
(1)①的反应类型是_______________。
(2)②的化学方程式为_______________。
(3)PMMA单体的官能团名称是________________________________________________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为_________________。
(5)G的结构简式为_________________________。
(6)下列说法正确的是_____________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.1 mol  与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是_______。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)画出基态Cu原子的价电子排布图__________________;
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________,配体中提供孤对电子的原子是____________。C、N、O三元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
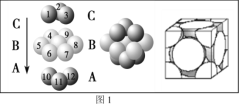
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________。
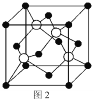
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为_________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________化合物(填“离子”、“共价”)
③已知该晶体的密度为![]() g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
某温度下,将2.0 mol CO2(g) 和6.0 mol H2(g)充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质分数变化情况如图所示,则P1_______P2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1________K3,T1、P1时H2的平衡转化率为______________。

②在恒容密闭容器里按体积比为1∶3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______(填序号)。
A.反应物的浓度增大 B.混合气体的密度减小
C.正反应速率小于逆反应速率 D.氢气的转化率减小
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量、产生的气体与加入盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:当加入HCl 的物质的量为1 mol时,溶液中所含溶质的化学式__________,a点溶液中各离子浓度由大到小的关系式为____________________________________。

(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp = 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀加入CaCl2溶液的最小浓度为___________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com