
科目: 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) 4— (绿色)、Cr2O72—(橙红色)、CrO42— (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_______,离子方程式____________________________。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol·L1的Na2CrO4溶液中c(Cr2O![]() )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
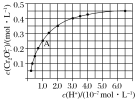
①当溶液酸性增强的时候,溶液颜色变化情况为:_________________。
②由图可知,溶液酸性增大,CrO42—的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42—的平衡转化率减小,则该反应的ΔH_____0(填“大于”“小于”或“等于”)。(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42—生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×105molL1)时,溶液中c(Ag+)___molL1,此时溶液中c(CrO42—)等于_____molL1 (已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目: 来源: 题型:
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:

请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验原理或操作正确的是 ( )
A. 用20 mL量筒量取15 mL酒精,加水5 mL,配制质量分数为75%酒精溶液
B. 在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5 mol·L-1
C. 实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950 mL、201.4 g
D. 实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
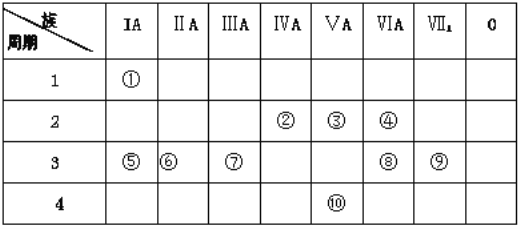
(1)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(2)写出元素④具有强氧化性的氢化物的电子式:_______________。
(3)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,不正确的是
A. 0.1 mol N2的质量是2.8 g
B. Mg的摩尔质量是24 g/mol
C. 2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D. 标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是
A. NH4Cl![]() NH3↑+HCl↑ B. 2Na2O2+2CO2===2Na2CO3+O2
NH3↑+HCl↑ B. 2Na2O2+2CO2===2Na2CO3+O2
C. 2NaOH+Cl2===NaCl+NaClO+H2O D. CaC2+H2O===Ca(OH)2+C2H2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 向硫酸钠溶液中加入氯化钡溶液 | 硫酸铜溶液中插入铁片 | 向FeSO4溶液中滴入NaOH溶液 | 加热盛有浓硫酸和木炭的试管 |
现象 | 产生白色沉淀 | 铁片上出现红色物质 | 产生白色沉淀,迅速变成灰绿色,最终变为红褐色 | 产生刺激性气味的气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】将下列物质进行分类:
A.O2和O3 B.![]() C和
C和![]() C C.CH2=CH-CH3和CH2=CH-CH2-CH3
C C.CH2=CH-CH3和CH2=CH-CH2-CH3
D.淀粉和纤维素 E.葡萄糖和蔗糖
F.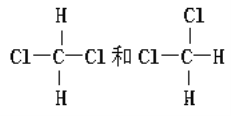 G.
G.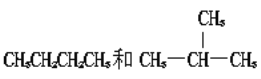
(1) 互为同位素的是 ________________(填编号,下同);
(2) 互为同素异形体的是____________;
(3) 互为同分异构体的是____________;
(4)互为同系物的是____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com