
科目: 来源: 题型:
【题目】下列反应中,水作还原剂的是
A. Mg+2H2O![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
B. 2F2+2H2O═4HF+O2
C. Cl2+H2O![]() HCl+HClO
HCl+HClO
D. 2Na2O2+2H2O═4NaOH+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的价电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是( )

A. 原子半径:b>c>a>d B. 气态氢化物热稳定性:a>d
C. d的氧化物常用于太阳能电池 D. 工业上电解c的氯化物冶炼单质c
查看答案和解析>>
科目: 来源: 题型:
【题目】I、将 5 g 钠铝合金投入到 200 mL 的水中,固体完全溶解,产生 4.48 L 标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为_______,所得溶液中溶质的物质的量浓度为__________(假设溶液体积变化忽略不计)。
Ⅱ、把由 NaOH、AlCl3、MgCl2 三种固体组成的混合物溶于足量水中,有 0.58 g 白色难溶物析出,向所 得溶液中逐滴加人 0.5 mol L-1 的盐酸,加入盐酸的体积和生成沉淀的质量如下图所示:

请计算:
(1)混合物中 MgCl2 的质量__________g;
(2)P 点表示盐酸加入的体积_________ml。
查看答案和解析>>
科目: 来源: 题型:
【题目】某些无公害农药果园利用电解原理,进行果品的安全生产,解决了农药残留所造成的生态及健康危害。下列正确的是( )
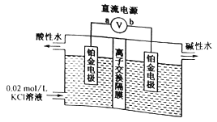
A. a为直流电源的负极,与之相连的电极做阴极 B. 离子交换膜为阴离子交换膜
C. “酸性水”具有强氧化性,具有杀菌效果 D. 阴极反应式为:H2O--2e-=H2↑+O2-
查看答案和解析>>
科目: 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。

已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。

(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
查看答案和解析>>
科目: 来源: 题型:
【题目】I、KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:□KClO3+□HCl(浓)→□KCl+□ClO2↑+□Cl2↑+□H2O+□__________
(1)请配平该化学方程式_____________________________________。
(2)浓盐酸在反应中显示出来的性质是______________________________(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
Ⅱ、已知反应:2H2CrO4+3H2O2=2Cr(OH)3↑+2H2O该反应中H2O2只发生如下变化过程H2O2→H2O
(1)该反应中的还原剂是__________________________。
(2)该反应中被还原的元素是_______________,还原产物是_____________________。
(3)若产生的气体在标准状况下体积为3.36L,则反应中转移了_________mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)将 28.5 g 氯化镁溶于水配成的 500mL 溶液中 Cl-浓度是______________,写出氯化镁的电离方程式_________________________________________________________。
(2)质量都是 50 g 的 HCl、NH3、CO2、O2 四种气体,在相同温度和相同压强条件下,体积最大的是____________。
(3)配制 90 mL 0.1 mol/L CuSO4 溶液,需要 CuSO4·5H2O_______ g,下列操作会使所配溶液浓度偏高的是__________________________。
A.容量瓶洗涤干净后未干燥 B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.定容时俯视刻度线 D.烧杯和玻璃棒未洗涤
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用草酸与浓硫酸反应制备CO,其原理如下:H2C2O4![]() CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅(黄色粉末)并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀),装置如图所示。
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅(黄色粉末)并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀),装置如图所示。
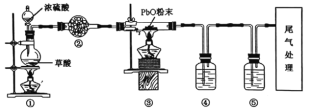
下列说法正确的是( )
A. ②、④、⑤中试剂依次为碱石灰、银氨溶液、澄清石灰水
B. ⑤中连续产生气泡且有明显现象时说明③中空气已排尽
C. 实验结束时,先熄灭①处酒精灯,再熄灭③处酒精灯
D. 实验过程中观察到③玻璃管中黄色粉末逐渐变成白色粉末
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质 | 电离方程式 | 电离常数K或Ksp |
CH3COOH | CH3COO | 1.76×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-7 K2=5.61×10-11 |
C6H5OH | C6H5OH | 1.1×10-10 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
NH3·H2O | NH3·H2O | 1.76×10-5 |
BaSO4 | BaSO4(s) | 1.07×10-10 |
BaCO3 | BaCO3(s) | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为_____________(填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式_______________________________。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)____c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是__________(填字母序号)。
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:____________。
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1______T2(填“>”、“=”或‘‘<”),T2温度时 Ksp(BaSO4)=_______________;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______(填字母序号)。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理_____次。[提示:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com