
科目: 来源: 题型:
【题目】氨在工农业生产中应用广泛。
(1)根据下图写出合成氨的热化学方程式是________________________。

(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___________(填“大于”、“等于”或“小于”)92.2 kJ,原因是______________;若加入催化剂,ΔH________(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N≡N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(4)N2H4可视为NH3分子中的H被-NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)==2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是
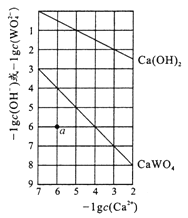
A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
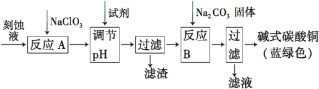
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去)。

请回答下列问题:
(1)写出下列物质的化学式:A_________、D_________、E_________、X________。
(2)在反应①~⑦中,不属于氧化还原反应的是______________________(填编号)。
(3)反应④的离子方程式是_____________________________。
(4)反应⑦的化学方程式是__________________________________;
该反应中每消耗0.3 mol的A,可转移电子______________mol。
(5)除去D溶液中混有的少量G的方法是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:

则:(1)① 不用通入O2氧化的方法除去CO的原因是 ______________________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
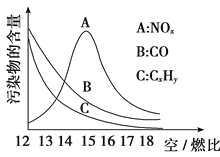
①随空/燃比增大,CO和CxHy的含量减少的原因是_____________________________。
②当空/燃比达到15后,NOx减少的原因可能是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究外界条件对工业合成氨反应的影响[N2(g)+3H2(g)![]() 2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
2NH3(g) △H<0],现往密闭容器中充入2mo1N2和4molH2模拟合成氨反应。在不同温度下,平衡体系中氨气的体积分数与总压强(P)的关系如图所示(分压=总压×物质的量分数)。下列说法中正确的是
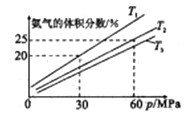
A. 若断裂1mo1N≡N键、同时断裂3mo1N-H键,则说明该反应达到平衡状态
B. 在T2、60MPa时,N2的平衡分压为17.5MPa
C. 若T1、T2温度下的平衡常数分别为K1、K3,刚K1<K3
D. 在T1、30MPa时,若经过2小时达到平衡,则:v(H2)=0.75mo1/(L·h)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如下图所示。下列说法正确的是( )

A. 当c(HC2O4-)=0.1mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B. 当c(HC2O4-)>amol/L时,c(H+)< c(H2C2O4),HC2O4-的水解程度大于电离程度
C. HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D. 将0.08mo1/L H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图。该电池工作时的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。 下列说法正确的是
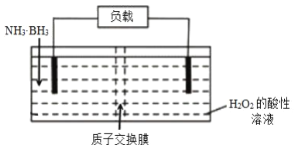
A. 电流从左侧电极经过负载后流向右侧电极
B. BO2-通过质子交换膜向正极移动
C. 负极附近溶液pH增大
D. 正极的反应式为 3H2O2+6H++6e-=6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
A. 溶液①中,c(CH3COO-)=c(H+)
B. 溶液①②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C. 溶液①②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D. 溶液①③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示。下列说法错误的是( )
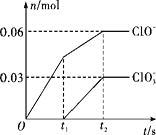
A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.42NA
C. 原苛性钾溶液中KOH的物质的量为0.3 mol
D. 生成物中Cl-的物质的量为0.21 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com