
科目: 来源: 题型:
【题目】某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3、KCl中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。
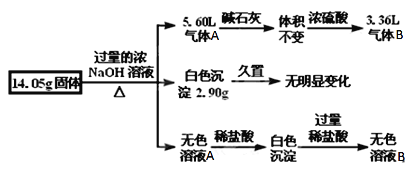
(1)气体B的成分是_________,由气体B的成分推测一定含有的物质的质量为________g。
(2)该固体混合物中_____(填“有”、“没有”或“不能确定”)KCl,理由是__________________,请另设计一种简单的方法检验该固体中是否含有KCl________________________________。
(3)另取14.05g固体混合物溶于1L 0.4mol/LNaHSO4溶液中,所得溶液中阴离子物质的量浓度之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:(提示:SiO2为难溶于盐酸的固体)

请回答下列问题:
(1)固体a的化学式为________。
(2)在Ⅱ中加过量的烧碱涉及到的反应离子方程式有Fe3+ + 3OH- =Fe(OH)3↓、H+ + OH- =H2O、_________________;Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(3)由Ⅲ中得到滤液c的实验操作为_____________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_________________________。
(4)0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合的离子反应方程式为_____________________________________。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和加入的H2SO4的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列几种氢键:①O—H…O,②N—H…N,③F—H…F,④O—H…N,按氢键从强到弱的顺序正确的是 ( )
A.③>①>④>② B.①>②>③>④
C.③>②>①>④ D.①>④>③>②
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 2.24L乙烷中含有的共价键数为0.7NA
B. 23 g钠在空气中充分燃烧生成过氧化钠时氧气得电子数为2NA
C. 11g超重水(3H216O)中含有的中子数为6NA
D. 0.1molN2与0.3molH2在一定条件下充分反应后,生成NH3分子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
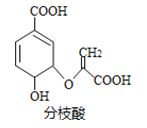
A. 分子中含有5种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:

(1)气体A的成分是_______(填化学式,下同) ,气体B的成分是_______。
(2)X溶液中一定存在的离子是______________。
(3)写出步骤①中发生反应的所有离子方程式:______________。
(4)写出步骤②中形成白色沉淀的离子方程式:______________。
(5)通过上述实验,溶液X中不能确定是否存在的离子是______________;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。

(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是__________________________________________,化学方程式为___________________________________________。
(3)A和水反应生成B和C的离子方程式为___________________________________,列出A的一种重要用途_________。
(4)反应①的离子方程式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是______价,Na2FeO4能给水消毒利用的是________性。
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原理是______________(用简要的文字叙述)。
(3)工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,配平反应的离子方程式:_____Fe3+ +_____OH-+____ClO- =_____FeO42-+ _____![]() + ______Cl- ,____________氧化剂为________,若反应过程中转移了0.5 mol电子,则还原产物的物质的量为________ mol。
+ ______Cl- ,____________氧化剂为________,若反应过程中转移了0.5 mol电子,则还原产物的物质的量为________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com