
科目: 来源: 题型:
【题目】某烃结构式如下:![]() ,有关其结构说法正确的是
,有关其结构说法正确的是
A. 所有原子可能在同一平面上 B. 该分子不存在顺反异构
C. 所有碳原子可能在同一平面上 D. 1 mol 该烃最多可与4 mol氢气反应
查看答案和解析>>
科目: 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
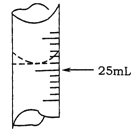
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目: 来源: 题型:
【题目】依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表:
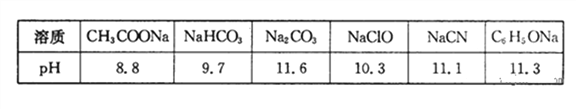
①上述盐溶液中的阴离子,结合H+能力最强的是______
②根据表中数据,浓度均为0.0lmol·L-1的下列五种物质的溶液中,酸性最强的是______(填编号);将各溶液分别稀释100倍,pH变化最小的是______(填编号)
![]()
③据上表数据,请你判断下列反应不能成立的是______(填编号)
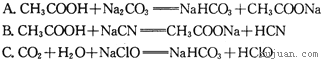
![]()
(2)已知常温下![]() ,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______.
,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______.
(3)已知可逆反应![]() 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
 ①写出该反应平衡常数的表达式:______
①写出该反应平衡常数的表达式:______
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度______(选填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活密切相关,下列描述正确的是( )
A.液氯是纯净物,具有漂白性
B.碘盐就是在食盐中加入一定量的碘单质
C.氧化钠可以做呼吸面具的供氧剂
D.漂白粉的有效成分是Ca(ClO)2,应密封保存
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。
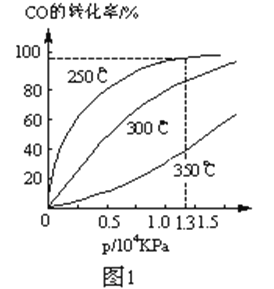
实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是______。
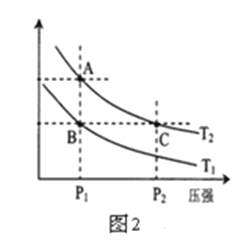
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
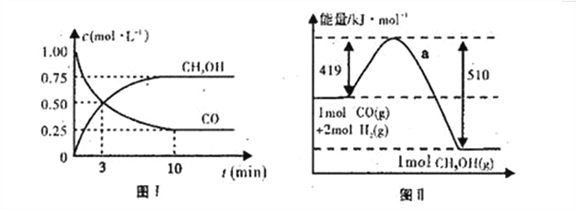
(4)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(5)写出该反应的热化学方程式______________________________
(6)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(7)恒容条件下,下列措施中能使![]() 增大的有______
增大的有______
A.升高温度 B.充入He气 C.再充入1molCO和2molH2 D.使用催化剂
(8)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡______(填“逆向移动”、“正向移动”、“不移动”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质或指定物质主要成分与化学式对应正确的是
A. 明矾 Al2(SO4)312H2OB. 漂白粉 CaClO
C. 纯碱 NaHCO3D. 水煤气 CO、H2
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H>0下列叙述正确的是( )
Z(g)+W(s);△H>0下列叙述正确的是( )
A. 加入少量W,逆反应速率增大 B. 当容器中气体密度不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用铁碳混合物处理含CuSO4废水获得金属铜。当休持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时问变化的曲线如图所示。下列推论不合理的是

A. 由图可知,活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁屑为负极
C. 利用铁碳混合物回收含CuSO4废水中铜的反应原理:Fe+CuSO4=FeSO4+Cu
D. 增大铁碳混合物中铁碳质量比(x),一定会提高废水中Cu2+的去除速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com