
科目: 来源: 题型:
【题目】分子式为C5H10O2的有机物为具有水果香味的油状液体,它与过量的NaOH溶液共热后蒸馏,若得到的有机物蒸气与氢气的摩尔质量之比为23,则有机物C5H10O2的结构简式可以是( )
A. HCOOCH2CH(CH3)2B. CH3CH2COOCH2CH3
C. CH3COOCH2CH2CH3D. CH3COOCH(CH3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物R的分子式为C12H18,经测定数据表明,分子中除含苯环外不再含有其他环状结构,且苯环上只有两个侧链(分别是-C2H5和-C4H9),符合此条件的烃的结构有
A. 6种 B. 9种 C. 12种 D. 15种
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 常温常压下,16 g CH4中含有4NA个C—H键
B. 1 mol·L-1 NaCl溶液中含有NA个Na+
C. 1 mol Cu与足量的稀硝酸反应产生NA个NO分子
D. 标准状况下,22.4 L氦气中含有2NA个He原子
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,据图分析不正确的是( )

A. 若物质A是动、植物细胞中均含有的储能物质,则A是脂肪
B. 物质b是氨基酸,若某种B分子由n个b分子(平均相对分子质量为m)组成的2条链组成,则该B分子的相对分子质量大约为mn﹣18(n﹣2)
C. 物质c在人体细胞中共有5种,分子中的含氮碱基不同决定了c的种类不同
D. 物质d是性激素,d和胆固醇、维生素D都属于固醇类物质
查看答案和解析>>
科目: 来源: 题型:
【题目】计算
(1)24.5 g硫酸的物质的量是________mol,1.5 mol碳酸钠的质量是______ g。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为10.8 g。则混合气体中CO的物质的量是________mol。
(3)用36.5%的浓盐酸(密度为1.25 g·cm-3)在容量瓶中配制480 mL1mol·L-1的稀盐酸。经计算需要__________mL浓盐酸。
(4) 将15.6 g过氧化钠与足量二氧化碳反应时,反应中转移_________mol电子。
(5)将钠、镁、铝各0.3mo1分别放入100mL1mol·L-1的盐酸中,同温同压下产生的气体体积比是____________。
(6)将20.8gCu、Fe合金与足量的稀硝酸反应后,收集到标准状况下NO气体6.72L,向反应后溶液中加入足量的NaOH溶液,生成的沉淀的质量是_________g。原来合金中含Cu______mol,Fe______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
科目: 来源: 题型:
【题目】现有34 g 某气体,它的摩尔质量为17g.mol-1。则:
(1)该气体为_____________mol
(2)该气体所含分子数为_________ NA
(3)该气体在标准状况下的体积为_________ L
(4) ________g H2O中的氧原子数目与保准状况22.4LCO2中的氧原子数目相同。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E、F六种前四周期元素,它们的原子序数依次增大。A、D同主族,A元素的原子最外层p能级的电子数等于次外层的电子总数,C原子最外层中有两个未成对的电子且与A同周期;C元素可分别与A、B、D、E生成RC2型化合物,并知EC2中E与C的质量比为1/1;F能形成红色(或砖红色)和黑色的两种氧化物。根据以上条件,回答下列问题:
(1)请写出F元素的名称 ___________F元素电子排布式___________________________
(2)在EC2分子中,E原子的杂化轨道类型为_________,分子的空间构型为 _______;
(3)H2E和H2C2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2E | 187 | 202 | 2.6 |
H2C2 | 272 | 423 | 以任意比互溶 |
H2E和H2C2的相对分子质量基本相同,造成上述几种物理性质差异的主要原因 _____________ 。
(4)元素A的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 (_______________)
A.分子中含有分子间氢键 C.只含有4个sp-s的σ键和1个p-p的π键
B.属于含有极性键的非极性分子 D.该氢化物分子中A原子采用sp2杂化
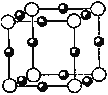
(5)B和F形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中B显-3价),则其化学式为 __________。F的常见离子和B的最简单氢化物形成的配离子的名称为___________,其水溶液颜色为________________。
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求写出方程式
(1)写出铝与氢氧化钠溶液反应的离子方程式_________________________________。
(2)过氧化钠与水反应的离子方程式__________________________________。
(3)工业上制取漂白粉的化学方程式为___________________________________。
(4)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边振荡,未得到白色沉淀的原因是发生了_______反应(写出反应的化学方程式)。
(5)氨的催化氧化反应的化学方程式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com