
科目: 来源: 题型:
【题目】化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)明矾是__________________,漂白粉的有效成分是________(均填化学式)。
(2)用少量氯气消毒的自来水养金鱼时,通常需要先将自来水晒一晒,其原因是________________________________________(用化学方程式表示)。
(3)绿柱石(绿宝石)矿藏其主要化学成分为BenAl2Si6O18,可用氧化物形式表示为nBeO·Al2O3·6SiO2,其n值为_______。
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是___________________。
(5)SiO2广泛存在于自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为确定盐酸、碳酸、硅酸的酸性强弱,设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。(提示:检验酸的酸性强弱可用强酸制取弱酸)
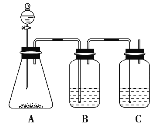
(1)锥形瓶中装某可溶性正盐,分液漏斗中所盛试剂应为________。
(2)装置B中所盛试剂是________________________________________,其作用是_____________。
(3)装置C中所盛试剂是___________________________________________,
C中反应的离子方程式是_________________________________________________。
(4)由此得到的结论是酸性:________>________>________。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.煮沸FeCl3饱和溶液可以制取Fe(OH)3胶体
B.鸡蛋清、浑浊的河水不可能属于同一类别
C.氢氧化铁胶体带正电
D.直径为10-8m的微粒不一定属于胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】缩醛在有机合成中常用于保护羰基或作为合成中间体,同时还是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。下面是G的一种合成路线:
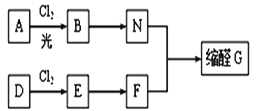
已知:①芳香烃A含氢元素的质量分数为8.7%,A的质谱图中,分子离子峰对应的最大质荷比为92; D的产重可以用来衡量一个国家的石油化工发展水平。
②同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
③
回答下列问题:
(1)A的结构简式是_____________________,E的名称是____________________________。
(2)由D生成E的反应类型是________,E→F的反应条件是_________________________。
(3)由B生成N的化学方程式为___________________________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉、效率高、污染物少的优点。维生素C的结构如右图。则维生素C分子中含氧官能团名称为_____________。

(5)缩醛G的结构简式为______________。G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式:_________________________。
①既能发生银镜反应,又能与FeC13发生显色反应;②核磁共振氢谐为4组峰。
(6)写出用2-丁烯为原料(其他无机试剂任选)制备顺丁橡胶(顺式聚1,3-丁二烯)的合成路线:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为
ρ g·cm-3,质量分数为w,其中含NH![]() 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
B. 溶质的质量分数为w=![]() ×100%
×100%
C. 溶液中c(OH-)=![]() mol·L-1
mol·L-1
D. 上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列实验方法合理的是________。
A.用加热法除去碳酸钠固体中的碳酸氢钠
B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取
C.实验室制取Al(OH)3:向AlCl3溶液中加入NaOH溶液至过量
D.向FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
(2)某研究性学习小组为研究氯气是否具有漂白性,设计如图所示实验装置。试根据实验装置回答下列问题:

A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液。
① 在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的________。
② B中的液体为____________,其作用为_________________________________。
③ A、C中有色布条的颜色变化分别为__________________________________,A、C的实验现象说明氯气是否具有漂白性?________(填“是”或“否”)。
④ D中NaOH溶液的作用是_______________________(用离子方程式说明)。
⑤ 将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去。小组内有甲、乙两种意见:
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色。
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则 ________(填“甲”或“乙”)的意见正确。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是
A. 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
B. Na2CO3比NaHCO3热稳定性强
C. Na2CO3和NaHCO3均不可与澄清石灰水反应
D. Na2CO3和NaHCO3均可与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+, 萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是_______。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为_____________________。
(5)右图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为_______,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com