
科目: 来源: 题型:
【题目】3.9克的镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的氢氧化钠溶液,若要生成沉淀最多,加入这种氢氧化钠溶液的体积是()
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I) 将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) ![]() 2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) ![]() 2CO(g) △H 2 = +172 kJ·mol-1
2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) ![]() 2Fe (s) + 3CO2(g) △H=_________。
2Fe (s) + 3CO2(g) △H=_________。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反式_________。
(II)如图所示,烧杯中都盛有稀硫酸。(1)中反应的离子方程式为______;比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是_____(用序号表示) 。
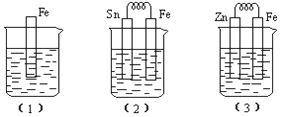
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)FeCl3 溶液和 Fe(OH)3 胶体的本质区别是:_____________。
(2)工业上制玻璃的原料有纯碱、石英和_____________(填名称)。
(3)工业上金属钠可用来制备钛等金属,利用了金属钠的____________性。
(4)盛放 NaOH 溶液的玻璃试剂瓶应选用____________ 塞(填“玻璃”或“橡胶”)。
(5)用四氯化碳萃取溴水后,分液时有机层从分液漏斗的_____________(填“下口放出”或“上口倒出”)。
(6)6.20 g Na2O 晶体中含离子数目是_____________(NA为阿伏加德罗常数的数值)。
(7)等质量的 NH3 和 H2S 中,氢原子的个数比是_________。
(8)加热某碱式碳酸镁晶体[4MgCO3Mg(OH)25H2O]至质量不再变化时,得到 10.0g 残留固体和__________L CO2(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃甲与氢气反应后的产物乙为(CH3)2CHCH2CH3,则相关说法不合理的是( )
A.产物乙的系统命名为:2甲基丁烷
B.烃甲可能是2甲基1,3丁二烯
C.0.1 mol产物乙完全燃烧可消耗17.92 L O2
D.烃甲与乙炔可能是同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
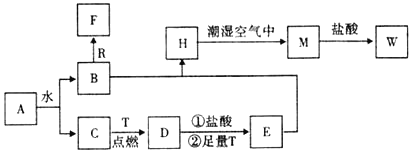
(1)物质A的化学式为_____,F化学式为____________;
(2)B和R在溶液中反应生成F的化学方程式为_____________________________;
(3)H在潮湿空气中变成M的化学方程式为_________________________________;
(4)A和水反应生成B和C的离子方程式为_________________________________;
(5)M投入盐酸中的离子方程式___________________________________________;
(6)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式____________________________;
(7)小苏打可作胃药,请写出其中和胃酸时的离子方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若用乙炔作为有机合成的原料时,下列过程可能生成产物为CH2Br—CHBrCl的是( )
A.加HCl再加Br2 B.加HCl再加HBr
C.加Cl2再加HBr D.加Cl2再加Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是( )
A. 铁锈的主要成分是Fe3O4
B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2
C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加过量铁粉,然后过滤
D. 因为Fe3+具有氧化性,所以可用来做净水剂
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
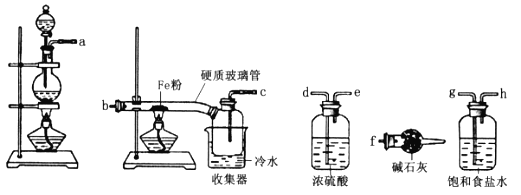
(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
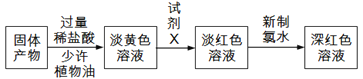
试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列化学反应在理论上可以设计成原电池的是____________。
A.C(s)+H2O(g)![]() CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)![]() NaC1(aq)+H2O(1) △H<0
NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)![]() 2H2O(1) △H<0
2H2O(1) △H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com